题目内容
7.香港兴建赤鱲角1248公倾新机场,是一个开山填海的庞大工程,共使用烈性炸药“TNT”5600吨.TNT炸药爆炸是时发生如下反应:21O2+4TNT=28CO2+10H2O+6N2则“TNT”的化学式是( )| A. | C7H5N3O6 | B. | C7H5N3O4 | C. | C5H3NO6 | D. | C7H5NO6 |
分析 根据反应的化学方程式21O2+4TNT=28CO2+10H2O+6N2,可判断反应前后C、H、O、N四种原子的个数变化,根据质量守恒定律解题.
解答 解:由反应的化学方程式21O2+4TNT=28CO2+10H2O+6N2,可判断反应前后C、H、O、N四种原子的个数为
反应前 反应后
C原子 0 28
H原子 0 20
O原子 42 66
N原子 0 12
根据化学变化前后原子的种类、数目不变,可判断物质TNT的4个分子中含28个C原子、20个H原子、24个O原子、12个N原子,则每个TNT的分子由7个C原子、5个H原子、6个O原子、3个N原子构成,则物质TNT的化学式为C7H5N3O6.
故选A.
点评 本题考查质量守恒定律,题目难度不大,注意根据守恒的思想解题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
| A. | 硫酸、纯碱、石膏 | B. | 硫酸、烧碱、胆矾 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 磷酸、熟石灰、苛性钠 |
18.下列有机物的命名正确的是( )
| A. | 2,4,5-三甲基己烷 | B. | 2,3 ___二甲基丁烷 | ||
| C. | 3,3,5,5-四甲基戊烷 | D. | 2,3-二甲基-2-乙基丁烷 |
2.有七种物质:①甲烷、②苯、③聚乙烯、④戊二烯、⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A. | ②③④⑤ | B. | ④⑤⑦ | C. | ①③④⑤ | D. | ④⑤⑥⑦ |
12.X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的非金属性比Y强的是( )
| A. | X的气态氢化物比Y的气态氢化物稳定 | |
| B. | X的氢化物的沸点比Y的氢化物的沸点低 | |
| C. | X原子的电子层数比Y原子的电子层数多 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
17.1克氮气含X个氮原子,则阿佛加德罗常数为( )
| A. | $\frac{1}{28}$X | B. | X | C. | 14X | D. | 28X |
 可简写为
可简写为  .降冰片烯的分子结构可表示为
.降冰片烯的分子结构可表示为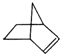
 .
.