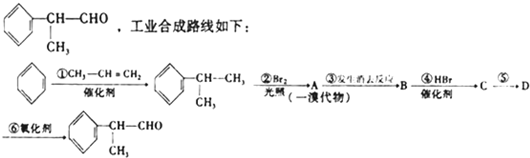
题目内容
(1)12.4gNa2X中含0.4mol Na+,则Na2X的摩尔质量是 .
(2)将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000ml、物质的量浓度为2mol/L、密度为1.20g/cm3的稀硫酸.所需浓硫酸的体积为 .
(2)将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000ml、物质的量浓度为2mol/L、密度为1.20g/cm3的稀硫酸.所需浓硫酸的体积为
考点:物质的量的相关计算
专题:
分析:(1)计算Na2X的物质的量,再根据M=
计算Na2X的摩尔质量;
(2)根据c=
计算浓硫酸的物质的量浓度,再根据稀释定律计算需要浓硫酸的体积.
| m |
| n |
(2)根据c=
| 1000ρω |
| M |
解答:
解:(1)Na2X的物质的量为
=0.2mol,Na2X的摩尔质量为
=62g/mol,故答案为:62g/mol;
(2)根据c=
可知,浓硫酸的物质的量浓度为
mol/L=18.4mol/L,根据稀释定律,需要浓硫酸的体积为
=108.7mL,故答案为:108.7mL.
| 0.4mol |
| 2 |
| 12.4g |
| 0.2mol |
(2)根据c=
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
| 1000mL×2mol/L |
| 18.4mol/L |
点评:本题考查物质的量有关计算,难度不大,注意理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| B、增大压强是通过提高活化分子的百分数来提高反应速率 |
| C、氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| D、水煤气是可再生能源 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温常压下,18克H2O含有2NA个氢原子 |
| B、1mol的Cl2与足量的NaOH溶液反应转移的电子数为2NA |
| C、1mol苯分子中含有的碳碳双键数为3 NA |
| D、5mol/L的Na2CO3溶液中含有的CO32-数目小于0.5 NA |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
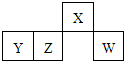
| A、原子半径:W>Z>Y>X |
| B、含Y元素的盐溶液一定显酸性 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |