题目内容
室温下对浓度,体积均相同的盐酸和醋酸溶液分别采取下列措施,有关叙述不正确的是( )
| A、醋酸溶液的PH值较大 |
| B、完全中和两溶液,需要浓度相同NaOH溶液的体积相等 |
| C、两者稀释相同倍数后,pH值变化相等 |
| D、加足量的锌充分反应后,两溶液中产生的氢气一样多 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A、盐酸是强酸,完全电离,醋酸是弱酸,部分电离,所以溶液中H+浓度盐酸>醋酸;
B、相同物质的量浓度的盐酸和醋酸,都是一元酸,可以提供的H+数量相同;
C、加水稀释后,醋酸仍然不是完全电离,所以pH值大于盐酸,不会相同;
D、相同物质的量浓度的盐酸和醋酸,都是一元酸,可以提供的H+数量相同.
B、相同物质的量浓度的盐酸和醋酸,都是一元酸,可以提供的H+数量相同;
C、加水稀释后,醋酸仍然不是完全电离,所以pH值大于盐酸,不会相同;
D、相同物质的量浓度的盐酸和醋酸,都是一元酸,可以提供的H+数量相同.
解答:
解:A、盐酸是强酸,完全电离,醋酸是弱酸,部分电离,所以溶液中H+浓度盐酸>醋酸,所以醋酸pH值较大,故A正确;
B、相同物质的量浓度的盐酸和醋酸,都是一元酸,可以提供的H+数量相同,所以需要浓度相同NaOH溶液的体积相等,故B正确;
C、加水稀释相同倍后,因为醋酸是弱酸,盐酸溶液的pH增大比醋酸大,所以盐酸的pH小于醋酸,故C错误;
D、体积相同,浓度相同的盐酸和醋酸两种溶液溶质物质的量相同,都是一元酸和Zn反应生成氢气相同,故D正确;
故选C.
B、相同物质的量浓度的盐酸和醋酸,都是一元酸,可以提供的H+数量相同,所以需要浓度相同NaOH溶液的体积相等,故B正确;
C、加水稀释相同倍后,因为醋酸是弱酸,盐酸溶液的pH增大比醋酸大,所以盐酸的pH小于醋酸,故C错误;
D、体积相同,浓度相同的盐酸和醋酸两种溶液溶质物质的量相同,都是一元酸和Zn反应生成氢气相同,故D正确;
故选C.
点评:本题考查了弱电解质的电离平衡应用,溶液稀释溶液中离子浓度变化的判断,酸碱恰好中和反应的实质,题目难度不大.

练习册系列答案
相关题目
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,将部分粉末加入水中,振荡,有白色沉淀生成,向悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;往所得溶液中滴入AgNO3溶液,有白色沉淀生成.根据上述实验现象,下列判断正确的是( )
| A、该白色粉末中肯定含有Ba(NO3)2、CaCl2、K2CO3 |
| B、该白色粉末中可能含有CaCl2 |
| C、该白色粉末中可能含有Ba(NO3)2 |
| D、该白色粉末中肯定含有Ba(NO3)2、K2CO3 |
能使水的电离平衡右移,且水溶液显碱性的离子是( )
| A、HSO3- |
| B、OH- |
| C、Al3+ |
| D、HCO3- |
在盛有碘水的试管中,加入少量四氯化碳后振荡,静置片刻后( )
| A、整个溶液变紫色 |
| B、整个溶液变棕色 |
| C、上层几乎无色,下层紫红色 |
| D、下层几乎无色,上层紫红色 |
 已知可逆反应:aA(g)+bB(g)?cC(g),物质的质量分数A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
已知可逆反应:aA(g)+bB(g)?cC(g),物质的质量分数A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1温度时达到化学平衡 |
| B、该反应在T1、T2、T3温度时,均未达到化学平衡 |
| C、升高温度,平衡向正反应方向移动 |
| D、该反应的正反应是放热反应 |
下列反应中,属于取代反应的是( )
A、CH2=CH2+HCl
| |||
B、2CH3CHO+O2
| |||
C、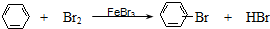 | |||
D、CH3CH2Br+NaOH
|
阿伏加德罗常数约为6.02×1023 mol-1,下列说法中一定正确的是( )
| A、3.4gNH3含共价键的数目约为0.2×6.02×1023个 |
| B、6.4g Cu投入300 mL 10mol/L的浓硝酸中,充分反应后转移0.2×6.02×1023个电子 |
| C、标准状况下,22.4 L SO2与11.2 L O2,混合充分反应,可得6.02×1023个SO3分子 |
| D、l L 0.5mol/L碳酸钠溶液中含有0.5×6.02×1023个CO32- |
下列有关溶液组成的描述合理的是( )
| A、漂白粉的水溶液中大量存在:Fe2+、Cl-、Al3+、I- |
| B、强碱性溶液中可能大量存在:Na+、K+、S2-、[Al(OH)4]- |
| C、常温下pH=7的溶液中大量存在:SO42-、Na+、Cl-、Fe3+ |
| D、无色酸性溶液中可能大量存在:K+、CH3COO-、HCO3-、MnO4- |



