题目内容
某钾肥溶液中的阴离子为N
、Cl-、S
、C
中的一种或几种,现在进行如下检验实验:

通过以上实验可知:
(1)此钾肥溶液中一定含有的阴离子是 .
(2)根据上述实验,能否判断该溶液里是否含有Cl-? .理由是 .
| O | - 3 |
| O | 2- 4 |
| O | 2- 3 |

通过以上实验可知:
(1)此钾肥溶液中一定含有的阴离子是
(2)根据上述实验,能否判断该溶液里是否含有Cl-?
考点:常见离子的检验方法
专题:离子反应专题
分析:溶液中进入过量的稀盐酸,生成无色气体,该气体能使澄清石灰水变浑浊,说明一定含有CO32-;
向无色溶液加入BaCl2溶液时生成白色沉淀,说明一定含有SO42-;
过滤,向滤液中加入稀硝酸和AgNO3溶液产生AgNO3白色沉淀,说明滤液中含有Cl-,由于第一步操作时引入了Cl-,不能证明原溶液中有无Cl-,NO3-不能通过实验证明是否存在,为可能有的离子.
向无色溶液加入BaCl2溶液时生成白色沉淀,说明一定含有SO42-;
过滤,向滤液中加入稀硝酸和AgNO3溶液产生AgNO3白色沉淀,说明滤液中含有Cl-,由于第一步操作时引入了Cl-,不能证明原溶液中有无Cl-,NO3-不能通过实验证明是否存在,为可能有的离子.
解答:
解:溶液中加入稀盐酸时,生成无色的能使澄清石灰水变浑浊的气体,说明一定含有CO32-;加入BaCl2溶液时生成白色沉淀,说明溶液中一定存在SO42-; 向滤液中加入稀硝酸和AgNO3溶液产生AgNO3白色沉淀,说明滤液中含有Cl-,由于第一步操作时引入了Cl-,不能证明原溶液中有无Cl-,
(1)根据以上分析可知,钾肥溶液中一定含有的阴离子是:SO42-、CO32-,
故答案为:SO42-、CO32-;
(2)由于在加硝酸银溶液前,已向溶液里加盐酸和BaCl2,盐酸和氯化钡都会电离产生Cl-,导致无法判断与AgNO3溶液作用生成白色沉淀AgCl的Cl-的来源,
故答案为:不能;因在加硝酸银溶液前,已向溶液里加盐酸和BaCl2,它们会电离产生Cl-,这样就无法判断与AgNO3溶液作用形成白色沉淀AgCl的Cl-的来源.
(1)根据以上分析可知,钾肥溶液中一定含有的阴离子是:SO42-、CO32-,
故答案为:SO42-、CO32-;
(2)由于在加硝酸银溶液前,已向溶液里加盐酸和BaCl2,盐酸和氯化钡都会电离产生Cl-,导致无法判断与AgNO3溶液作用生成白色沉淀AgCl的Cl-的来源,
故答案为:不能;因在加硝酸银溶液前,已向溶液里加盐酸和BaCl2,它们会电离产生Cl-,这样就无法判断与AgNO3溶液作用形成白色沉淀AgCl的Cl-的来源.
点评:本题考查了常见阴离子的检验,题目难度中等,注意熟练掌握常见离子的检验方法,注意检验离子存在时排除其它离子离子的干扰,能够根据离子反应的现象判断存在的离子.

练习册系列答案
相关题目
将足量CO2分别通入下列各溶液中,所含离子仍能大量共存的是( )
| A、K+、AlO2-、Cl-、NO3- |
| B、Na+、CH3COO-、C6H5O-、HCO3- |
| C、Na+、ClO-、SO42-、Cl- |
| D、NH4+、Al3+、SO42-、H+ |
关于下列四个说法正确的是( )
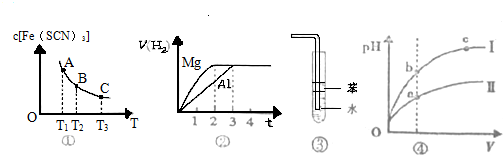

| A、已知图①是体系Fe3++3SCN-?Fe(SCB)3中c[Fe(SCN)3]与温度T的平衡图象,则A点与B点相比,A点的Fe3+浓度大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③可用于吸收HCl气体,并防倒吸 |
| D、图④是某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,II为醋酸稀释时pH的变化曲线 |

 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示: