题目内容
1.用锌粒与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )| A. | 加热 | B. | 滴加少量硫酸铜溶液 | ||
| C. | 不用铁片,改用铁粉 | D. | 加少量浓硝酸 |
分析 锌与稀硫酸反应制取氢气时,反应的实质为锌与H+反应,升高温度、增大氢离子的浓度、增大接触面积等,化学反应速率加快,以此来解答.
解答 解:锌与稀硫酸反应制取氢气时,反应的实质为锌与H+反应,
A、加热,活化分子的百分数增大,反应速率加快,故A不选;
B、滴加少量CuSO4溶液,置换出Cu,形成原电池,发生电化学反应,反应速率加快,故B不选;
C、不用铁片,改用铁粉,增大反应物的接触面积,反应速率加快,故C不选;
D、加少量浓硝酸,生成二氧化氮而不是氢气,所以不能使氢气生成速率加快,故D选;
故选D.
点评 本题考查影响反应速率的因素,题目难度不大,本题注意温度、浓度、催化剂等条件对反应速率的影响,本题特别是注意原电池反应原理以及固体表面积对反应速率的影响.

练习册系列答案
相关题目
17.欲除去下列物质中混有的少量杂质(括号内物质为杂质),错误的是( )
| A. | 苯(苯酚):氢氧化钠溶液,充分震荡静止后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入氢氧化钠溶液,充分震荡静止后,分液 | |
| D. | 乙酸(乙醇):加入金属钠,蒸馏 |
9.下列有关化学反应速率的说法正确的是( )
| A. | 用铁片和稀硫酸反应制取氢气时,改用 98%的浓硫酸可以加快产生氢气的速率 | |
| B. | 100mL2mol•L-1 的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2 的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 | |
| D. | 汽车尾气中的 NO 和 CO 可以缓慢反应生成 N2 和 CO2,减小压强反应速率减慢 |
6.下列反应的离子方程式正确的是( )
| A. | 铁与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氢氧化铁溶液与盐酸反应:OH-+H+═H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 标准状况下,4.48L氦气中所含原子数为0.2NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 带温下,l.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
11.向含有等物质的量浓度的NaBr、KI、NaCl的混合液中通入足量的氯气,充分反应后将溶液蒸干,并灼烧所得的固体,最后剩余的固体成分可能是( )
| A. | KCl、Br2 | B. | NaCl、KCl | C. | KI、NaCl | D. | NaCl、KCl、I2 |
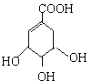 (提示:环丁烷
(提示:环丁烷 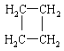 可简写成□)
可简写成□)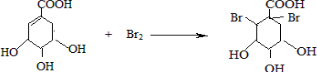 ,
,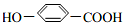 ),其反应类型是消去反应,
),其反应类型是消去反应,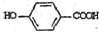 +2Br2→
+2Br2→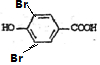 +2HBr.
+2HBr.