题目内容
2. 镁化合物和氯气均具有广泛用途,请回答下列问题:
镁化合物和氯气均具有广泛用途,请回答下列问题:(1)写镁和氯气反应产物的电子式

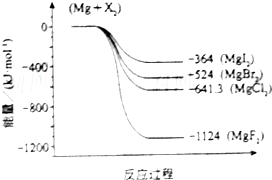
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).则下列选项中正确的是ABC
A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.g与X2的反应是放热反应
C.gBr2与Cl2反应的△H<0
D.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应.请回答下列问题:
①该反应的离子方程式为Cl2+H2O?H++Cl-+HClO,平衡常数表达式为K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$
②在上述平衡体系中加入少量NaCl固体,平衡将逆向移动(填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将变大,氯气和水反应的平衡常数将不变(填“变大”、“变小”、“不变”).
③已知:H2CO3?HCO3-+H+ Ka1(H2CO3)=4.45×10-7
HCO3-?CO32-+H+ Ka2(H2CO3)=5.61×10-11
HClO?H++ClO- Ka(HClO)=2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:将少量的氯气通入到过量的碳酸钠溶液中Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-.
分析 (1)反应生成氯化镁,为离子化合物;
(2)由图可知,生成MgF2是放热最多;
(3)①氯气与水反应生成盐酸、HClO,K等于生成物幂之积与反应物幂之积的比;
②加入少量NaCl固体,氯离子浓度增大,增大压强,气体溶解度增大,但K只与温度有关;
③由Ka可知酸性强弱,少量的氯气通入到过量的碳酸钠溶液,反应生成碳酸氢钠、氯化钠、次氯酸钠.
解答 解:(1)氯化镁是由离子键形成的离子化合物,电子式为 ,故答案为:
,故答案为: .
.
(2)根据反应过程中的能量变化可知,生成MgF2是放热最多,说明形成的离子键最强,化合物最稳定,所以只有选项D是错误的,故答案为ABC;
(3)①氯气溶于水生成盐酸和次氯酸,方程式为Cl2+H2O?H++Cl-+HClO,则平衡常数的表达式是K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$,
故答案为:Cl2+H2O?H++Cl-+HClO;K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$;
②如果加入氯化钠固体,则氯离子浓度增大,平衡向逆反应方向移动.压强越大,气体的溶解度越,但平衡常数只和温度有关系,所以平衡常数不变,
故答案为:逆向移动;变大;不变;
③根据平衡常数可知,碳酸的酸性强于次氯酸的,次氯酸的酸性强于碳酸氢钠的,所以根据较强的酸制取较弱的酸的原理可知,反应的方程式为Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-,故答案为:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-.
点评 本题考查化学平衡移动、离子反应及化学键等,为高考常见题型和高频考点,侧重于学生的分析能力的考查,把握习题中的信息、能量变化图象、K的影响因素为解答该题的关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | “地沟油”可以制成肥皂,从而提高资源的利用率 |
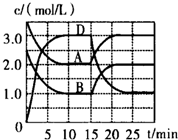 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |
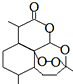 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
| A. | 10B的质子数是10 | B. | 10B的中子数与核外电子数不同 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B20具有较强的化学活性 |
| A. | 向AlCl3溶液中加入过量氨水 | B. | 向Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向NaAlO2溶液中加入过量稀盐酸 |