题目内容
20.向密闭容器中加入1molH2,1molBr2,发生H2(g)+Br2(g)?2HBr(g)达到化学平衡.现有另外四种起始投入量.①1molH2 1molHBr ②2molHBr③0.5molH2,0.5molBr21molHBr ④1molH2,1molBr2 2molHBr回答下列问题(1)恒温恒容条件下,若HBr的物质的量为n,则上述配比在平衡时HBr的物质的量仍为n的是②③(填序号);若HBr体积分数为a%,则上述配比在平衡时仍为a%的是②③④(填序号)
(2)恒温恒压条件下,若HBr的物质的量为n,则上述配比在平衡时HBr的物质的量仍为n是②③(填序号);若HBr体积分数为a%,则上述配比在平衡时仍为a%的是②③④(填序号)
分析 (1)该反应为气体体积不变的反应,恒温恒容条件下,若加入1molH2,1molBr2平衡时HBr的物质的量为n,则上述配比转化到一边即n(H2)=1mol,n(Br2)=1mol,则与原平衡完全等效,在平衡时HBr的物质的量仍为n;则上述配比转化到一边满足H2与Br2物质的量之比为1:1,则与原平衡成比例等效,则HBr体积分数为a%,据此判断;
(2)该反应为气体体积不变的反应,恒温恒压条件下,若加入1molH2,1molBr2平衡时HBr的物质的量为n,则上述配比转化到一边即n(H2)=1mol,n(Br2)=1mol,则与原平衡完全等效,在平衡时HBr的物质的量仍为n;则上述配比转化到一边满足H2与Br2物质的量之比为1:1,则与原平衡成比例等效,则HBr体积分数为a%,据此判断;
解答 解:(1)该反应为气体体积不变的反应,恒温恒容条件下,若加入1molH2,1molBr2平衡时HBr的物质的量为n,则上述配比转化到一边即n(H2)=1mol,n(Br2)=1mol,则与原平衡完全等效,在平衡时HBr的物质的量仍为n;则上述配比转化到一边满足H2与Br2物质的量之比为1:1,则与原平衡成比例等效,则HBr体积分数为a%,
①1molH2 1molHBr 转化到一边得n(H2)=1.5mol,n(Br2)=0.5mol,与原平衡不等效;
②2molHBr转化到一边得n(H2)=1mol,n(Br2)=1mol,与原平衡完全等效,所以平衡时HBr的物质的量仍为n,HBr体积分数仍为a%;
③0.5molH2,0.5molBr21molHBr转化到一边得n(H2)=1mol,n(Br2)=1mol,与原平衡完全等效,所以平衡时HBr的物质的量仍为n,HBr体积分数仍为a%;
④1molH2,1molBr2 2molHBr转化到一边得n(H2)=2mol,n(Br2)=2mol,与原平衡成比例等效,所以平衡时HBr的物质的量为2n,HBr体积分数仍为a%;
所以平衡时HBr的物质的量仍为n的是②③;若HBr体积分数为a%,则上述配比在平衡时仍为a%的是②③④,故答案为:②③;②③④;
(2)该反应为气体体积不变的反应,恒温恒压条件下,若加入1molH2,1molBr2平衡时HBr的物质的量为n,则上述配比转化到一边即n(H2)=1mol,n(Br2)=1mol,则与原平衡完全等效,在平衡时HBr的物质的量仍为n;则上述配比转化到一边满足H2与Br2物质的量之比为1:1,则与原平衡成比例等效,则HBr体积分数为a%,
①1molH2 1molHBr 转化到一边得n(H2)=1.5mol,n(Br2)=0.5mol,与原平衡不等效;
②2molHBr转化到一边得n(H2)=1mol,n(Br2)=1mol,与原平衡完全等效,所以平衡时HBr的物质的量仍为n,HBr体积分数仍为a%;
③0.5molH2,0.5molBr21molHBr转化到一边得n(H2)=1mol,n(Br2)=1mol,与原平衡完全等效,所以平衡时HBr的物质的量仍为n,HBr体积分数仍为a%;
④1molH2,1molBr2 2molHBr转化到一边得n(H2)=2mol,n(Br2)=2mol,与原平衡成比例等效,所以平衡时HBr的物质的量为2n,HBr体积分数仍为a%;
所以平衡时HBr的物质的量仍为n的是②③;若HBr体积分数为a%,则上述配比在平衡时仍为a%的是②③④,故答案为:②③;②③④;
点评 本题考查的是等效平衡及化学平衡的有关计算,采用极限反应法是解题的关键,难度较大.

 备战中考寒假系列答案
备战中考寒假系列答案| 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 正盐 | 酸式盐 |
| CO2 | Na2O | H2CO3 | NaOH | Na2CO3 | NaHCO3 |
| A. | 水和醋酸 | B. | 溴和水 | C. | 水和植物油 | D. | 猪油和汽油 |
| A. | 氮气分子的结构式:N-N | B. | Mg2+的结构示意图: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 二氧化碳电子: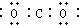 |
| A. | 标准状况下,等体积的水和CO2,含有的氧原子数目为1:2 | |
| B. | 含有NA个阴离子的Na2O2与足量水反应,转移电子数为2NA | |
| C. | 向含有1molFeI2的溶液中通入适量氯气,当有NA个Fe2+被氧化时,共转移电子数为3NA | |
| D. | 一个NO分子质量为a g,一个NO2分子质量是b g,则NA个O2的质量为(b-a)NAg |


