题目内容
1.以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:
回答下列问题:
(1)步骤Ⅲ中可选用C(填序号)试剂调节溶液的pH.
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液
(2)在空气中煅烧FeCO3生成产品I的化学反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(3)检验产品II晶体中是否含有少量的氯化物杂质需用到的试剂是硝酸钡、硝酸银、稀硝酸,进一步提纯产品II的方法是蒸发结晶;
(4)步骤Ⅳ中,FeCO3 达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol•L-1.试判断所得FeCO3 中是否混有Fe(OH)2否(填“是”或“否”),请通过简单计算说明理由溶液中c(Fe2+)•c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成 (已知:Ksp[Fe(OH)2]=4.9×10-17).
(5)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是防止NH4HCO3分解,减少Fe2+的水解.
分析 在矿铁中加入酸,SiO2不与酸反应,过滤后所得滤渣为SiO2,滤液A中加入过量铁粉将Fe3+还原为Fe2+,可加入氨水调节溶液pH至5~6.5,过滤后在滤液B中加入碳酸氢铵可生成FeCO3,高温煅烧可得Fe2O3,硫酸铵溶液和KCl合成无氯钾肥硫酸铵钾,据此答题.
解答 解:在矿铁中加入酸,SiO2不与酸反应,过滤后所得滤渣为SiO2,滤液A中加入过量铁粉将Fe3+还原为Fe2+,可加入氨水调节溶液pH至5~6.5,过滤后在滤液B中加入碳酸氢铵可生成FeCO3,高温煅烧可得Fe2O3,硫酸铵溶液和KCl合成无氯钾肥硫酸铵钾,
(1)步骤Ⅲ可加入氨水调节溶液pH至5~6.5,其它物质都具有氧化性,可将亚铁离子氧化,故答案为:C;
(2)由流程图可知,煅烧FeCO3生成产品Ⅰ氧化铁和二氧化碳,Fe元素化合价升高,反应物中应有氧气,化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(3)检验产品II晶体中是否含有少量的氯化物杂质应先排除硫酸根离子的干扰,先加过量的硝酸钡,再用硝酸银、稀硝酸检验氯离子,所以需用到的试剂是硝酸钡、硝酸银、稀硝酸,进一步提纯产品II的方法是蒸发结晶,
故答案为:硝酸钡、硝酸银、稀硝酸;蒸发结晶;
(4)由浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡,溶液中c(Fe2+)•c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成,
故答案为:否;溶液中c(Fe2+)•c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成;
(5)步骤Ⅳ的反应温度一般需控制在35℃以下,温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解,
故答案为:防止NH4HCO3分解,减少Fe2+的水解.
点评 本题考查了铁及其化合物性质的分析应用,主要是流程分析理解和反应过程的判断,题目难度中等.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案| A. | 1:4 | B. | 1:5 | C. | 1:4.5 | D. | 1:2 |
| A. | 1mol Ne含有的电子数目为10NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸含有相同的氧原子数 | |
| C. | 2.8g氮气所含的分子数为NA | |
| D. | 1.8gNH4+中含有的质子数为NA |
| A. | 乙醇和水 | B. | 香油和食盐水 | ||
| C. | 黄河水中的泥沙与水 | D. | 食盐水中获得食盐 |
| A. | C5H10 | B. | C5H12O | C. | C5H11Br | D. | C5H12 |

 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.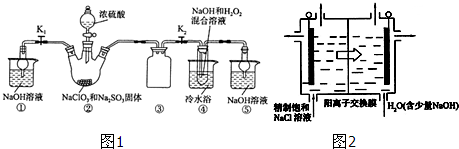
 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2: .
. +3NaOH
+3NaOH CH3COONa+2H2O+
CH3COONa+2H2O+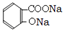 .
.