题目内容
下列离子方程式书写不正确的是( )
| A、向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | ||||
| B、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | ||||
| C、向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | ||||
D、铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液:2Cl _+2H2O
|
考点:离子方程式的书写
专题:
分析:A.双氧水能够氧化碘离子生成单质碘;
B.氢氧化钡足量反应生成碳酸钡、NaOH和水;
C.不符合反应的客观事实;
D.铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液,生成氯气、氢气和氢氧化钠.
B.氢氧化钡足量反应生成碳酸钡、NaOH和水;
C.不符合反应的客观事实;
D.铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液,生成氯气、氢气和氢氧化钠.
解答:
解:A.向海带灰浸出液中加入硫酸、双氧水,离子方程式:2I-+2H++H2O2═I2+2H2O,故A正确;
B.碳酸氢钠溶液与足量氢氧化钡溶液混合,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故B正确;
C.向Al2(SO4)3溶液中加入过量的氨水,离子方程式:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C错误;
D.铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液,离子方程式:2Cl-+2H2O
H2↑+Cl2↑+2OH-,故D正确;
故选:C.
B.碳酸氢钠溶液与足量氢氧化钡溶液混合,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故B正确;
C.向Al2(SO4)3溶液中加入过量的氨水,离子方程式:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C错误;
D.铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液,离子方程式:2Cl-+2H2O
| ||
故选:C.
点评:本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式书写应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、SO2具有还原性,故可作漂白剂 |
| B、Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、氨是氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱的原料 |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为  ,b与c形成化合物的电子式
,b与c形成化合物的电子式  为下列比较中正确的是( )
为下列比较中正确的是( )
 ,b与c形成化合物的电子式
,b与c形成化合物的电子式  为下列比较中正确的是( )
为下列比较中正确的是( )| A、原子半径:a>c>d>b |
| B、电负性:a>b>d>c |
| C、最高价含氧酸的酸性:c>d>a |
| D、第一电离能:d>a>b>c |


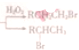 (R:烃基或氧原子,R′:烃基)
(R:烃基或氧原子,R′:烃基)
 写出以丙烯和
写出以丙烯和 为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2
为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2 →
→


