题目内容
已知乙烯能发生以下转化:
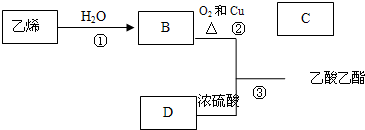
(1)工业制取乙烯的原料为 ;
(2)写出B、D化合物中官能团:B中含官能团 ;D中含官能团 ;
(3)写出反应的化学方程式及反应类型:
① 反应类型
② 反应类型
③ 反应类型
(4)若工业上用空气代替氧气进行反应②,主要优点是 ,缺点是 .

(1)工业制取乙烯的原料为
(2)写出B、D化合物中官能团:B中含官能团
(3)写出反应的化学方程式及反应类型:
①
②
③
(4)若工业上用空气代替氧气进行反应②,主要优点是
考点:有机物的推断
专题:推断题
分析:乙烯在催化剂条件下与水发生加成反应生成CH3CH2OH,CH3CH2OH被催化氧化可生成CH3CHO,乙醇和D反应生成乙酸乙酯,则D应为CH3COOH,结合有机物的结构和性质解答该题.
解答:
解:乙烯在催化剂条件下与水发生加成反应生成CH3CH2OH,CH3CH2OH被催化氧化可生成CH3CHO,乙醇和D反应生成乙酸乙酯,则D应为CH3COOH,则
(1)工业可由石油为原料经裂解生成乙烯,故答案为:石油;
(2)有以上分析可知B为CH3CH2OH,含有羟基,D为CH3COOH,含有羧基,故答案为:羟基;羧基;
(3)①为乙烯在催化剂条件下与水发生加成反应生成CH3CH2OH,方程式为,
故答案为:CH2═CH2+H2O→CH3CH2OH;加成;
②为CH3CH2OH被催化氧化可生成CH3CHO,方程式为2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;氧化;
③为乙酸与乙醇在浓硫酸作用下的酯化反应或或取代反应生成乙酸乙酯,反应的方程式为 ,
,
故答案为: ;酯化反应或取代反应;
;酯化反应或取代反应;
(4)若工业上用空气代替氧气进行反应②,由于氧气的浓度较低,则反应较慢,但空气原料丰富,成本较低,
故答案为:原料易得,成本低;反应速率慢.
(1)工业可由石油为原料经裂解生成乙烯,故答案为:石油;
(2)有以上分析可知B为CH3CH2OH,含有羟基,D为CH3COOH,含有羧基,故答案为:羟基;羧基;
(3)①为乙烯在催化剂条件下与水发生加成反应生成CH3CH2OH,方程式为,
故答案为:CH2═CH2+H2O→CH3CH2OH;加成;
②为CH3CH2OH被催化氧化可生成CH3CHO,方程式为2CH3CH2OH+O2
| ||
| △ |
故答案为:2CH3CH2OH+O2
| ||
| △ |
③为乙酸与乙醇在浓硫酸作用下的酯化反应或或取代反应生成乙酸乙酯,反应的方程式为
 ,
,故答案为:
 ;酯化反应或取代反应;
;酯化反应或取代反应;(4)若工业上用空气代替氧气进行反应②,由于氧气的浓度较低,则反应较慢,但空气原料丰富,成本较低,
故答案为:原料易得,成本低;反应速率慢.
点评:本题考查有机物的推断和合成,题目难度不大,本题注意把握有机物的官能团的性质,为解答该题的关键.

练习册系列答案
相关题目
相同体积的Na2SO4、MgSO4、Fe2(SO4)3溶液,分别加入足量的BaCl2溶液,产生相同质量的沉淀,则三种溶液的物质的量浓度之比是( )
| A、1:1:1 |
| B、1:1:3 |
| C、1:2:3 |
| D、3:3:1 |
一定温度下,用水稀释c mol?L-1的稀醋酸,若用KW表示水的离子积,则下列数值随水量的增加而增大的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列在水溶液中能大量共存的离子组是( )
| A、Fe3+、K+、CO32-、OH- |
| B、Ba2+、Na+、SO42-、NO3- |
| C、Na+、Ag+、HCO3-、Cl- |
| D、K+、NH4+、Br-、I- |
常温下,将1.92g铜加入到100ml H2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气.下列有关结论不正确的是( )
| A、溶解的铁粉为2.8g |
| B、原溶液中c(SO42-)=0.5mol/L |
| C、原混合溶液中c(H+)=1.2mol/L |
| D、原溶液中n(NO3-)=0.08mol |
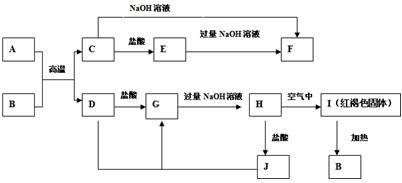
 图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.根据图示回答问题:
图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.根据图示回答问题: