题目内容
某兴趣小组为检验泻盐中是否含有SO42-,选用稀盐酸和BaCl2溶液进行探究,其中稀盐酸的作用是排除某杂质离子的干扰,该杂质离子是( )
| A、Mg2+ |
| B、Ca2+ |
| C、CO32- |
| D、NO3- |
考点:硫酸根离子的检验
专题:物质检验鉴别题
分析:在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰.
解答:
解:在检验SO42-时,先加盐酸以排除CO32-离子的干扰,再加入氯化钡溶液,若有白色沉淀产生,则证明有 SO42-.
故选C.
故选C.
点评:本题考查了SO42-离子的检验方法,注意在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰,题目较简单.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
在水溶液中能大量共存的一组离子是( )
| A、Na+、OH-、Cl-、CH3COO- |
| B、H+、Na+、Fe2+、NO3- |
| C、K+、Ca2+、Cl-、NO3- |
| D、K+、NH4+、OH-、SO42- |
以下物质间的每步转化通过一步反应就能实现的是( )
| A、NaHCO3→Na2O→Na2CO3 |
| B、Fe→FeCl3→FeCl2 |
| C、Si→H2SiO3→Na2SiO3 |
| D、Al2O3→Al(OH)3→NaAlO2 |
镍氢电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2根据此反应式判断,此电池放电时,负极上发生反应的物质是( )
| A、NiO(OH) |
| B、Ni(OH)2 |
| C、H2 |
| D、H2和NiO(OH) |
下列根据反应原理设计的应用,不正确的是( )
| A、CO32-+H2O?HCO3-+OH 用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3+H+ 明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?x H2O↓+4HCl 用TiCl4制备TiO2 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行.质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源.该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+.下列对该燃料电池的描述中正确的是( )
①正极反应为O2+4H++4e-=2H2O
②负极反应为2H2-4e-=4H+
③总的化学反应为2H2+O2
2H2O
④氢离子通过电解质向正极移动.
①正极反应为O2+4H++4e-=2H2O
②负极反应为2H2-4e-=4H+
③总的化学反应为2H2+O2
| ||
④氢离子通过电解质向正极移动.
| A、①②③ | B、②③④ |
| C、①②④ | D、①②③④ |
通过复习总结,你认为下列对化学知识概括合理的组合是( )
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑤过氧化氢和液氮的分子中都有非极性共价键
⑥共价化合物中可能含有离子键
⑦非极性分子中一定含有非极性键.
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑤过氧化氢和液氮的分子中都有非极性共价键
⑥共价化合物中可能含有离子键
⑦非极性分子中一定含有非极性键.
| A、只有②④⑤ |
| B、只有②③⑥ |
| C、只有①③⑤ |
| D、只有④⑤⑦ |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: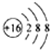 | ||
B、NH4Cl的电子式: | ||
C、原子核内有18个中子的氯原子:
| ||
D、NH3 的电子式: |