题目内容
 如图所涉及的物质中,C、D、E均为单质,且E为日常生活中常见金属,其余均 为化合物.它们之间的转化关系如图所示(反应中生成的水及次要产物均已略去).请回答:
如图所涉及的物质中,C、D、E均为单质,且E为日常生活中常见金属,其余均 为化合物.它们之间的转化关系如图所示(反应中生成的水及次要产物均已略去).请回答:(1)写出有关物质的化学式
A
(2)指出MnO2在相关反应中的作用:反应①中是
(3)若反应①是在加热条件下进行,则A是
(4)写出反应②的化学方程式
(5)向G中加入NaOH溶液,观察到的现象为
分析:中学阶段与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用浓盐酸和MnO2制备Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,为日常生活中常见金属,则F为Fe3O4,G为FeCl2,H为FeCl3,结合物质的性质解答该题.
解答:解:中学阶段与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用浓盐酸和MnO2制备Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,为日常生活中常见金属,则F为Fe3O4,G为FeCl2,H为FeCl3,
(1)由以上分析可知A为H2O2,F为Fe3O4,H为FeCl3,故答案为:H2O2;Fe3O4;FeCl3;
(2)在不加热条件下,用H2O2和MnO2制备O2,H2O2起到催化剂的作用,在加热条件下用浓盐酸和MnO2制备Cl2,发生:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,MnO2起到氧化剂的作用,
故答案为:催化;氧化;
(3)反应①是在加热条件下进行,应加热分解氯酸钾来制备氧气,发生2KClO3
2KCl+3O2↑,故答案为:KClO3;
(4)反应②为浓盐酸和二氧化锰在加热条件下反应制备氯气的反应,反应的方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(5)G为FeCl2,加入氢氧化钠生成氢氧化亚铁,氢氧化亚铁不稳定,可被氧化生成氢氧化铁,反应的现象为生成白色絮状沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:生成白色絮状沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色.
(1)由以上分析可知A为H2O2,F为Fe3O4,H为FeCl3,故答案为:H2O2;Fe3O4;FeCl3;
(2)在不加热条件下,用H2O2和MnO2制备O2,H2O2起到催化剂的作用,在加热条件下用浓盐酸和MnO2制备Cl2,发生:4HCl(浓)+MnO2
| ||
故答案为:催化;氧化;
(3)反应①是在加热条件下进行,应加热分解氯酸钾来制备氧气,发生2KClO3
| ||
(4)反应②为浓盐酸和二氧化锰在加热条件下反应制备氯气的反应,反应的方程式为MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(5)G为FeCl2,加入氢氧化钠生成氢氧化亚铁,氢氧化亚铁不稳定,可被氧化生成氢氧化铁,反应的现象为生成白色絮状沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:生成白色絮状沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色.
点评:本题考查无机物的推断,为高考常见题型和高频考点,侧重于物质性质的综合应用以及学生的分析能力的考查,题目难度不大,本题注意二氧化锰的作用判断和反应特征.

练习册系列答案
相关题目
 如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去.
如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去.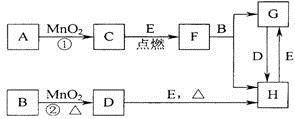
 如图所涉及的物质均为中学化学中的常见物质,其中C、D为非金属单质气体,E为金属单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
如图所涉及的物质均为中学化学中的常见物质,其中C、D为非金属单质气体,E为金属单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.