题目内容
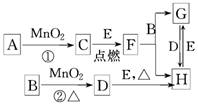
如图所涉及的物质均为中学化学中的常见物质,其中其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
(1)写出有关物质的化学式:F
(2)写出B与MnO2共热获得D的化学方程式
(3)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX)=1.8×10-10.将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10-4mol/L,则生成沉淀所需原AgNO3溶液的最小浓度为

(1)写出有关物质的化学式:F
Fe3O4
Fe3O4
,AH2O2
H2O2
.(2)写出B与MnO2共热获得D的化学方程式
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(3)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX)=1.8×10-10.将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10-4mol/L,则生成沉淀所需原AgNO3溶液的最小浓度为
3.6×10-6mol/L
3.6×10-6mol/L
.若向AgX悬浊液中滴加KI溶液,观察到的现象白色沉淀会转变成黄色沉淀
白色沉淀会转变成黄色沉淀
.分析:中学阶段与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用浓盐酸和MnO2制备Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,是目前人类应用最广泛的金属,则F为Fe3O4,G为FeCl2,H为FeCl3,结合物质的性质以及题目要求可解答该题.
解答:解:与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用浓盐酸和MnO2制备Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,是目前人类应用最广泛的金属,则F为Fe3O4,G为FeCl2,H为FeCl3,
(1)由以上分析可知F为Fe3O4,A为H2O2,
故答案为:Fe3O4; H2O2;
(2)在加热条件下用浓盐酸和MnO2制备Cl2,发生:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(3)HCl的浓度为2×10-4mol/L,稀释后浓度为1×10-4mol/L,要生成沉淀,应满足1×10-4×c(AgNO3)≥1.8×10-10,c(AgNO3)≥1.8×10-6mol/L,
则原AgNO3溶液的最小浓度为2×1.8×10-6mol/L=3.6×10-6mol/L,
若向AgX悬浊液中滴加KI溶液,由于AgI溶度积更小,则可生成黄色AgI沉淀.
故答案为:3.6×10-6mol/L;白色沉淀会转变成黄色沉淀.
(1)由以上分析可知F为Fe3O4,A为H2O2,
故答案为:Fe3O4; H2O2;
(2)在加热条件下用浓盐酸和MnO2制备Cl2,发生:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(3)HCl的浓度为2×10-4mol/L,稀释后浓度为1×10-4mol/L,要生成沉淀,应满足1×10-4×c(AgNO3)≥1.8×10-10,c(AgNO3)≥1.8×10-6mol/L,
则原AgNO3溶液的最小浓度为2×1.8×10-6mol/L=3.6×10-6mol/L,
若向AgX悬浊液中滴加KI溶液,由于AgI溶度积更小,则可生成黄色AgI沉淀.
故答案为:3.6×10-6mol/L;白色沉淀会转变成黄色沉淀.
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,较为综合,该题的突破口为与二氧化锰的反应,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
 如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去.
如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去. 如图所涉及的物质均为中学化学中的常见物质,其中C、D为非金属单质气体,E为金属单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
如图所涉及的物质均为中学化学中的常见物质,其中C、D为非金属单质气体,E为金属单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.