题目内容
碘与氢气反应的热化学方程式为:
①I2(g)+H2(g) 2HI(g) ΔH= - 9.48 kJ·mol-1
2HI(g) ΔH= - 9.48 kJ·mol-1
②I2(s)+H2(g) 2HI(g) ΔH= + 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
2HI(g) ΔH= + 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
A.反应①的产物比反应②的产物稳定
B.I2(s) I2(g) ΔH= + 17.00 kJ·mol-1
I2(g) ΔH= + 17.00 kJ·mol-1
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol I2(g)中通入1 mol H2(g),反应后放热9.48 kJ
C
【解析】
试题分析:A、同一种物质在相同条件下,能量一样多,A错误;B、利用盖斯定律可得出1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ,B错误,C项正确;D、反应是可逆反应,反应物不能完全转化,放热达不到9.48 kJ,D错误。答案选C。
考点:考查化学反应热的计算。

(10分)(1)已知某反应的平衡常数表达式为:K= ,则它所对应反应的化学方程式是 。
,则它所对应反应的化学方程式是 。
(2)合成甲醇的主要反应是:2H2(g)+CO(g)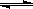 CH3OH(g) △H=-90.8 kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g) △H=-90.8 kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度(mol/L) | 0.2 | 0.1 | 0.4 |
(A)该时间段内反应速率v(H2)=
(B)比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
(C)反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向
(填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小” 或“不变”)。
 g,一个12C的原子质量是b g,用NA是阿伏加德罗常数的值,下列叙述中不正确的是
g,一个12C的原子质量是b g,用NA是阿伏加德罗常数的值,下列叙述中不正确的是 个原子
个原子 D.由已知信息可得:
D.由已知信息可得: mol-1
mol-1
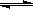 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是