��Ŀ����
��10�֣���1����֪ij��Ӧ��ƽ�ⳣ������ʽΪ��K= ����������Ӧ��Ӧ�Ļ�ѧ����ʽ�� ��
����������Ӧ��Ӧ�Ļ�ѧ����ʽ�� ��
��2���ϳɼ״�����Ҫ��Ӧ�ǣ�2H2(g)+CO(g)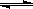 CH3OH(g) ��H=-90.8 kJ��mol-1��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
CH3OH(g) ��H=-90.8 kJ��mol-1��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
���� | H2 | CO | CH3OH |
Ũ�ȣ�mol/L�� | 0.2 | 0.1 | 0.4 |
��A����ʱ����ڷ�Ӧ����v(H2)=
��B���Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v�� v�棨�>������<����=����
��C����Ӧ�ﵽƽ����������������䣬��ֻ�������������Сһ�룬ƽ����
(�������������)�ƶ���ƽ�ⳣ��K (���������С�� ���䡱)��
��1��C+H2O (g) 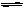 CO + H2 ��2����A��0.08 mol/(L?min) ��B���� ��C������ ����
CO + H2 ��2����A��0.08 mol/(L?min) ��B���� ��C������ ����
��������
�����������1��ƽ�����ʽΪ��K=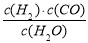 ��������ΪCO��H2����Ӧ�ﺬ��H2O������ѧ�������ֱ�Ϊ1��1��1������ԭ���غ㣬����һ��Ӧ��Ϊ����C����Ӧ��ѧ����ʽΪC��s��+H2O��g��?CO��g��+H2��g������2����A���ɱ������ݿ�֪��l0min�ڼ״���Ũ�ȱ仯Ϊ0.4mol/L����v��CH3OH��=
��������ΪCO��H2����Ӧ�ﺬ��H2O������ѧ�������ֱ�Ϊ1��1��1������ԭ���غ㣬����һ��Ӧ��Ϊ����C����Ӧ��ѧ����ʽΪC��s��+H2O��g��?CO��g��+H2��g������2����A���ɱ������ݿ�֪��l0min�ڼ״���Ũ�ȱ仯Ϊ0.4mol/L����v��CH3OH��=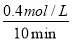 =0.04mol/��L?min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=2v��CH3OH��=2��0.04mol/��L?min��=0.08mol/��L?min������B��10minʱ��CO��Ũ��Ϊ0.1mol/L��������Ũ��Ϊ0.2mol/L���״���Ũ��Ϊ0.4mol/L���ʴ�ʱ��Ũ����Qc=
=0.04mol/��L?min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=2v��CH3OH��=2��0.04mol/��L?min��=0.08mol/��L?min������B��10minʱ��CO��Ũ��Ϊ0.1mol/L��������Ũ��Ϊ0.2mol/L���״���Ũ��Ϊ0.4mol/L���ʴ�ʱ��Ũ����Qc=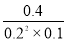 =100��С��ƽ�ⳣ��160���ʷ�Ӧ������Ӧ���У���v����v�棻��C�������������Сһ�룬ѹǿ����ƽ���������С�ķ����ƶ�����ƽ��������Ӧ�ƶ���ƽ�ⳣ��ֻ���¶�Ӱ�죬��ѹǿ�أ��¶Ȳ��䣬ƽ�ⳣ�����䡣
=100��С��ƽ�ⳣ��160���ʷ�Ӧ������Ӧ���У���v����v�棻��C�������������Сһ�룬ѹǿ����ƽ���������С�ķ����ƶ�����ƽ��������Ӧ�ƶ���ƽ�ⳣ��ֻ���¶�Ӱ�죬��ѹǿ�أ��¶Ȳ��䣬ƽ�ⳣ�����䡣
���㣺���黯ѧƽ�ⳣ�������塣

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�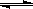 2HI(g) ��H= - 9.48 kJ��mol-1
2HI(g) ��H= - 9.48 kJ��mol-1