题目内容
对于:2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述错误的是
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800 kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800 kJ·mol-1
D
【解析】
试题解析:A、反应的△H=-5800kJ/mol,即焓变小于零,则反应是放热反应,故A正确;B、焓变的影响因素:物质的状态、物质的量的多少以及物质前面化学计量数的大小,故B正确;C、热化学方程式的含义:25℃、101kPa下,2molC4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ,故C正确;D、燃烧热的含义:完全燃烧1mol纯物质生成最稳定的氧化物所放出的能量,即丁烷的燃烧热为2900kJ/mol,故D错误.
考点:热化学方程式

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案(13分)有A、B、C、D、E五种元素,其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
请回答下列问题:
(1)写出元素E的基态原子的电子排布式_________________。
(2)CA3分子中C原子的杂化类型是________;在元素E的硫酸盐溶液中逐渐通入CA3,可以观察到的实验现象是 ,发生的有关反应的离子方程式为 。
(3)C与A还可形成C2A4、CA5等化合物,二者都能与盐酸反应。则C2A4与盐酸反应的离子方程式为 。CA5还可与水反应产生无色气体,且所得溶液显碱性,则CA5的电子式为 ,与水反应的化学方程式 。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
1mol该离子中含有 个σ键。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_________(填序号)。
a.平面正方形 B.正四面体 c.三角锥形 D.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示。
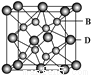
其中D离子的配位数为 ________,该晶体的化学式为__________。
 2HI(g) ΔH= - 9.48 kJ·mol-1
2HI(g) ΔH= - 9.48 kJ·mol-1 2AB(气)达到平衡的标志是
2AB(气)达到平衡的标志是 