题目内容
17.用量最大、用途最广的合金是钢,根据其化学成分,可分为两大类:合金钢 和碳素钢,适宜于制作不锈钢用具的钢是合金钢.分析 目前世界上用量最大的合金是钢;钢一般可分为碳素钢和合金钢,碳素钢中含有碳元素,易形成电化学腐蚀,不锈钢具有抗腐蚀性.
解答 解:用量最大、用途最广的合金是钢,钢一般可分为碳素钢和合金钢两大类,碳素钢中含有碳元素,易形成电化学腐蚀,不适宜于制作不锈钢用具,不锈钢具有抗腐蚀性,不锈钢中含有的主要金属是镍、铬、铁,是这三种元素为主制成的合金钢,适宜于制作不锈钢用具;
故答案为:钢;合金钢;碳素钢;合金钢.
点评 本题考查了金属材料的应用,完成此题,要分析钢的组成和具有的性质,题目难度不大.

练习册系列答案
相关题目
8.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L 1mo/L的FeCl3溶液中含有的Fe3+为1NA | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1mol铜与足量硫反应,转移的电子总数为NA | |
| D. | 18g D2O(重水)中所含电子个数为10 NA |
5.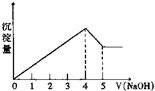 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )| A. | 2:1 | B. | 4:1 | C. | 1:2 | D. | 1:1 |
12.下列离子方程式中,正确的是( )
| A. | 向盐酸中加入几滴碳酸钠溶液:H++CO32-═HCO3- | |
| B. | 向三氯化铁溶液中加入碘化钾溶液:Fe3++2I-═Fe2++I2 | |
| C. | 过量的铁粉加入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 等物质的量浓度的明矾溶液与氢氧化钡溶液按体积比1:2混合:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
2.用NA表示阿伏伽德罗常数,下列叙述错误的是( )
| A. | 标准状况下,22.4LH2含有的分子数为NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 1L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L. |
9.下列实验操作正确的是( )
| A. |  检查容量瓶是否漏水 | B. |  给液体加热 | ||
| C. |  称量 | D. |  过滤 |
6.化学与工农业和人类生活密切相关.下列说法中正确的是( )
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2 | |
| B. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| C. | 自来水厂可用氯气来杀菌消毒,因此氯气无毒 | |
| D. | 高纯度的硅单质广泛用于光导纤维 |
7.可逆反应N2(g)+3H2(g)?2NH3(g),△H=-Q kJ•mol-1(Q>0).有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2.下列叙述正确的是( )
| A. | 达到平衡时,两容器中反应物的转化率相同 | |
| B. | 平衡时甲容器中NH3(g)的体积分数比乙容器中的小 | |
| C. | Q1=0.2Q | |
| D. | 平衡时甲容器中气体的压强为开始时压强的3$\frac{3}{5}$ |
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.