题目内容
海水电池是我国1991年研制的以铝-空气-海水为能源的新型电池,可用于航海标志灯的供电.
(1)下列化学反应装置的模型,能体现海水电池工作原理的是

(2)海洋电池工作过程中,负极的电极反应式为 ,该极是电子 (填“流出”或“流入”)极,发生 反应.
(1)下列化学反应装置的模型,能体现海水电池工作原理的是

(2)海洋电池工作过程中,负极的电极反应式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)原电池为自发进行的氧化还原反应,根据原电池的形成条件判断;
(2)原电池工作时,铝为负极,被氧化,电极方程式为Al-3e-=Al3+.
(2)原电池工作时,铝为负极,被氧化,电极方程式为Al-3e-=Al3+.
解答:
解:(1)铝-空气-海水电池中,铝为负极,碳为正极,铝被氧化失去电子,而氧气在正极得到电子,故答案为:C;
(2)负极发生氧化反应,Al失去电子生成铝离子,电极反应式为:Al-3e-═Al3+,原电池工作时,电子从负极经外电路流向正极,
故答案为:Al-3e-=Al3+;流出;氧化.
(2)负极发生氧化反应,Al失去电子生成铝离子,电极反应式为:Al-3e-═Al3+,原电池工作时,电子从负极经外电路流向正极,
故答案为:Al-3e-=Al3+;流出;氧化.
点评:本题考查了原电池原理,为高考高频考点,侧重于学生的分析能力的考查,注意把握原电池的电极判断以及电解方程式的书写,难度不大.

练习册系列答案
相关题目
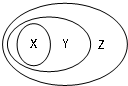 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 甲烷 | 烷烃 | 烃 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
锌粒与稀盐酸反应时,下列因素不会影响氢气产生速率的是( )
| A、盐酸的浓度 |
| B、用同质量锌粉替换锌粒 |
| C、溶液的温度 |
| D、加少量硫酸钠 |

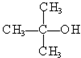 ③
③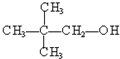 ④
④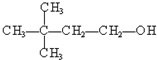 ⑤
⑤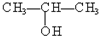
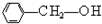 )
)

