题目内容
14.硫-氨热化学循环制氢示意图如图1: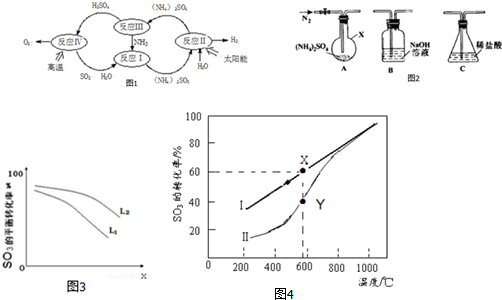
(1)反应Ⅱ是将太阳能转化为电能,再转化为化学能,电解池阳极的电极反应式SO32--2e-+H2O=SO42-+2H+;
(2)反应Ⅲ中控制反应条件很重要,不同条件下硫酸铵分解产物不同.连接装置A-B-C,检查气密性,按如图2所示重新加入试剂.通入N2排尽空气后,于400℃加热装置A 至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、B之间的导气管内有少量白色固体.经检验,该白色固体和装置B内溶液中有SO32-,无SO42-.进一步研究发现,气体产物中无氮氧化物.(NH4)2 SO4在400℃分解的化学方程式是:3(NH4)2SO4$\frac{\underline{\;600℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑;
(3)反应Ⅳ:2H2SO4(l)═2SO2(g)+O2(g)+2H2O(l)△H=+462kJ/mol,它由两步反应组成:i.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ/mol
ii.SO3(g)分解.
iii.H2O(l)═H2O(g)△H=+44kJ/mol
①L(L1、L2),X可分别代表压强或温度.如图3表示 L一定时,ii中SO3(g)的平衡转化率随X的变化关系.
i.X代表的物理量是:压强,
ii.判断L1、L2的大小关系,并简述理由:L1<L2 SO3分解吸热,在压强相同的情况下,随温度的升高,SO3的转化率增大;
②反SO3分解的热化学方程式为:2SO3(g)═2SO2(g)+O2(g)△H=+196kJ/mol;
(4)恒温密闭容器中,控制不同温度进行SO3分解实验.SO3起始浓度均为 cmol•L-1,测定SO3的转化率,结果如图4,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率.
①图中点X点处的平衡常数K=0.675c,
②Y点对应温度下的反应速率:v(正)>v(逆) (选填:>,<,=);随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是:温度升高,反应速率加快,达到平衡所需要的时间缩短.
分析 (1)据图分析,反应Ⅱ是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,
(2)反应Ⅲ分析可知,不同条件下硫酸铵分解产物不同,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,配平书写方程式;
(3)①i.由图可知,X.越大,转化率越低;
ii.分解反应为吸热反应,温度高,转化率大;
②a.2H2SO4(l)═2SO2(g)+O2(g)+2H2O(l)△H=+462kJ/mol,
b.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ/mol
c.H2O(l)═H2O(g)△H=+44kJ/mol
盖斯定律计算2c+a-2b得到SO3(g)分解的热化学方程式;
(4)①恒温密闭容器中,控制不同温度进行SO3分解实验.SO3起始浓度均为 cmol•L-1,测定SO3的转化率在X点为60%,结合平衡三行计算得到平衡浓度计算得到平衡常数;
②Y点时反应还没有达到平衡状态,正向进行;温度的升高,曲线b向曲线a逼近,反应速率加快.
解答 解:(1)反应Ⅱ是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,阳极上是亚硫酸根离子得到电子生成硫酸根离子,电极反应为:SO32--2e-+H2O=SO42-+2H+,
故答案为;SO32--2e-+H2O=SO42-+2H+;
(2)分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,分解反应方程式为:3(NH4)2SO4$\frac{\underline{\;600℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑,
故答案为:3(NH4)2SO4$\frac{\underline{\;600℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑;
(3)①i.由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强,故答案为:压强;
ii.由2SO3(g)=2SO2(g)+O2(g)△H>0,在压强相同的情况下,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2,
故答案为:L1<L2 SO3分解吸热,在压强相同的情况下,随温度的升高,SO3的转化率增大;
②a.2H2SO4(l)═2SO2(g)+O2(g)+2H2O(l)△H=+462kJ/mol,
b.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ/mol
c.H2O(l)═H2O(g)△H=+44kJ/mol
盖斯定律计算2c+a-2b得到SO3(g)分解的热化学方程式为2SO3(g)=2SO2(g)+O2(g)△H=+196kJ•mol-1,
故答案为:2SO3(g)═2SO2(g)+O2(g)△H=+196kJ/mol;
(4)①恒温密闭容器中,控制不同温度进行SO3分解实验.SO3起始浓度均为 cmol•L-1,测定SO3的转化率在X点为60%,
2SO3(g)=2SO2(g)+O2(g)
起始量(mol) c 0 0
转化量(mol)0.6c 0.6c 0.3c
平衡量(mol)c-0.6c 0.6c 0.3c
平衡常数K=$\frac{0.3c×(0.6c)^{2}}{(0.4c)^{2}}$=0.675c,
故答案为:0.675c;
②Y点时反应还没有达到平衡状态,正向进行,所以正反应速率大于逆反应速率,温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:>;温度升高,反应速率加快,达到平衡所需要的时间缩短;
点评 本题考查学生根据图象获取信息的能力,涉及电极式的书写、化学反应速率、化学平衡影响因素、平衡常数计算、盖斯定律等,综合知识的应用,题目难度中等.

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案| A. |  实验室制硝基苯 | B. |  检查装置气密性 | ||
| C. |  利用排空气法收集丙烷 | D. |  石油分馏 |
| A. | 吸滤既能加快过滤速率和得到更干燥的沉淀,又能使沉淀颗粒变粗变大 | |
| B. | 在“阿司匹林的合成”实验中,把从盐酸中析出的晶体进行抽滤,用酒精洗涤晶体1~2次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率 | |
| C. | 记录Na2S2O3与稀硫酸的反应时间,应从溶液混合时开始计时,到刚出现浑浊结束 | |
| D. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤而不要用水洗涤主要是为了减少晶体损失 |
| A. | 用酸性高锰酸钾溶液鉴别苯、甲苯和环己烯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用水鉴别乙醇、甲苯和溴苯 | |
| D. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
 互为同分异构体的是( )
互为同分异构体的是( )| A. |  | B. |  | C. |  | D. |  |
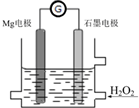 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 镁电极是该电池的负极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-═Mg2+ | |
| D. | 电池工作时,电子从石墨电极经导线流向Mg电极,溶液中阳离子流向正极 |


