题目内容
12.常见的短周期元素A、B、C、D、E的原子序数依次增大.常温下,A、C可形成A2C2和A2C两种液态化合物,B原子最外层电子数是次外层电子数的2倍,D原子电子层数与最外层电子数相等,E与C同主族.(1)上述五种元素中,非金属性最强的是氧(填写元素名称).
(2)元素D形成的简单离子的原子结构示意图为
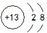 .
.(3)A的单质与C的单质在强酸性条件下构成燃料电池,其正极反应式为O2+4H++4e-=2H2O.
(4)上述五种元素,由其中三种元素组成的易溶于水的物质中,能促进水电离的物质是:Al2(SO4)3(写出该物质的化学式,下同),能抑制水电离的物质是:H2SO4或H2CO3等.
(5)常温常压时,2.8 g BC气体在3.2 g C2气体中完全燃烧,生成BC2气体时放出28.3 kJ的热量,则表示BC燃烧的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol.
分析 常见的短周期元素A、B、C、D、E的原子序数依次增大.B原子最外层电子数是次外层电子数的2倍,则B原子有2个电子层,最外层电子数为4,则B为C元素;常温下,A、C可形成A2C2和A2C两种液态化合物,则A为H元素、C为O元素;E与C同主族,则E为S元素;D原子电子层数与最外层电子数相等,D原子序数大于氧元素,则D处于第三周期,最外层电子数为3,则D为Al元素,据此解答.
解答 解:常见的短周期元素A、B、C、D、E的原子序数依次增大.B原子最外层电子数是次外层电子数的2倍,则B原子有2个电子层,最外层电子数为4,则B为C元素;常温下,A、C可形成A2C2和A2C两种液态化合物,则A为H元素、C为O元素;E与C同主族,则E为S元素;D原子电子层数与最外层电子数相等,D原子序数大于氧元素,则D处于第三周期,最外层电子数为3,则D为Al元素,
(1)同主族自上而下非金属性减弱,同周期自左而右非金属性增强,故上述五种元素中,非金属性最强的是氧元素,故答案为:氧;
(2)元素D形成的简单离子为Al3+,核外有10个电子,有2个电子层最外层电子数为8,离子结构示意图为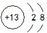 ,故答案为:
,故答案为: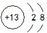 ;
;
(3)氢气、氧气在强酸性条件下构成燃料电池,正极发生还原反应,氧气在正极放电,酸性条件下生成水,正极反应式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
(4)上述五种元素,由其中三种元素组成的易溶于水的物质中,能促进水电离的物质是:Al2(SO4)3,能抑制水电离为的物质是:H2SO4或H2CO3等.
故答案为:Al2(SO4)3;H2SO4或H2CO3等;
(5)常温常压时,2.8gCO气体在3.2gO2气体中完全燃烧,生成CO2气体时放出28.3kJ的热量,CO与氧气恰好反应,则1molCO完全燃烧放出的热量为28.3kJ×$\frac{1mol×28g/mol}{2.8g}$=283kJ,故CO燃烧的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol.
点评 本题以元素推断为载体,考查常用化学用语、原电池、热化学方程式书写、元素化合物知识等,注意对基础知识的全面掌握.

| A. | 16g CH4所含原子数目为NA | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 2.4g Mg与足量盐酸反应转移的电子数为0.2NA |
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液; 产生白色沉淀 | NO3-在酸性条件下能氧化SO2生成SO42- |
| B | 向Fe(NO3)2溶液中滴加少量盐酸; 浅绿色变深绿色 | 溶液中存在Fe2+水解平衡移动 |
| C | 向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;用激光灯照射液体,有一条明亮“通路” | 该液体分散质直径介于1nm与100nm之间 |
| D | 向FeI2溶液中滴加酸化的双氧水和淀粉溶液;溶液为蓝色 | Fe2+的还原性比I-的还原性弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 按系统命名法,有机物 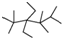 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 | |
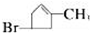
| B. |  主链上的碳原子数是5 主链上的碳原子数是5 | |
| C. | 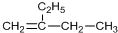 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | |
| D. |  的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |

 .化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
.化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
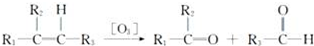
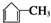 ,G2所含官能团为醛基、羰基.
,G2所含官能团为醛基、羰基.
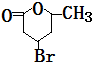 +H2O.
+H2O.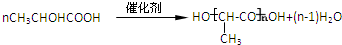 .
.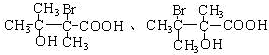 任意一种.
任意一种.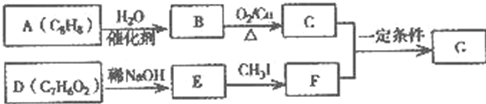

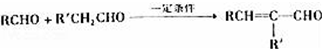
 .
. .
.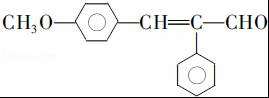 .
.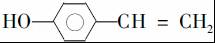 (写结构简式).
(写结构简式).
 .
.