题目内容
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、7gCnH2n中含有的氢原子数目为NA |
| B、18gD2O中含有的质子数目为10NA |
| C、标准状况下,22.4LCHCl3中含有氯原子数目为3NA |
| D、1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.CnH2n的最简式为CH2,根据最简式计算出含有的氢原子物质的量及数目;
B.重水中含有10个质子,其摩尔质量为20g/mol;
C.标准状况下,三氯甲烷的状态不是气体,不能使用标况下气体摩尔体积计算其物质的量;
D.碳酸钠溶液中,碳酸根离子部分水解,溶液中碳酸根离子数目减少.
B.重水中含有10个质子,其摩尔质量为20g/mol;
C.标准状况下,三氯甲烷的状态不是气体,不能使用标况下气体摩尔体积计算其物质的量;
D.碳酸钠溶液中,碳酸根离子部分水解,溶液中碳酸根离子数目减少.
解答:
解:A.7g CnH2n中含有0.5mol最简式CH2,含有1mol氢原子,有的氢原子数目为NA,故A正确;
B.18g重水的物质的量为:
=0.9mol,0.9mol重水中含有9mol质子,含有的质子数目为9NA,故B错误;
C.标况下,三氯甲烷不是气体,不能使用标况下的气体摩尔体积计算22.4L甲烷的物质的量,故C错误;
D.1L L0.5mol/LNa2CO3 溶液中含有溶质碳酸钠0.5mol,碳酸根离子部分水解,溶液中碳酸根离子数目小于0.5mol,含有的CO32-数目小于0.5NA,故D错误;
故选A.
B.18g重水的物质的量为:
| 18g |
| 20g/mol |
C.标况下,三氯甲烷不是气体,不能使用标况下的气体摩尔体积计算22.4L甲烷的物质的量,故C错误;
D.1L L0.5mol/LNa2CO3 溶液中含有溶质碳酸钠0.5mol,碳酸根离子部分水解,溶液中碳酸根离子数目小于0.5mol,含有的CO32-数目小于0.5NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知次氯酸是比碳酸还弱的酸,氯水中存在平衡Cl2+H2O?HCl+HClO,HClO?H++ClO-.达平衡后,要使HClO浓度增大,可加入( )
| A、H2S |
| B、Na2CO3 |
| C、盐酸 |
| D、NaOH |
下列装置或操作能达到实验目的是( )
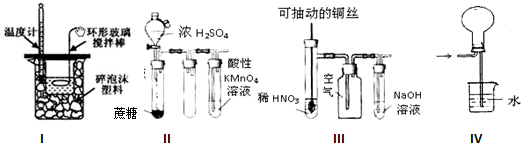

| A、实验I:中和热测定 |
| B、实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C、实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、实验IV:可用于HCl气体的吸收 |
下列实验中(固定仪器省略),没有错误的是( )
A、 |
B、 |
C、 |
D、 |
下列说法正确的是( )
| A、室温下,pH之和为14的氨水与盐酸等体积混合,溶液一定呈中性 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+c(Fe2+)═c(OH-)+c(SO42-) |
| C、向醋酸溶液中加入适量醋酸钠,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.4 mol/L HCl与0.1 mol/L NaAlO2等体积混合,所得溶液中:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
反应:NO+CO2?NO2+CO在密闭容器中进行,下列哪项条件加快该反应速率( )
| A、缩小体积使压强增大 |
| B、体积不变充入CO2使压强增大 |
| C、体积不变充入He气使压强增大 |
| D、压强不变充入N2使体积增大 |