题目内容
已知次氯酸是比碳酸还弱的酸,氯水中存在平衡Cl2+H2O?HCl+HClO,HClO?H++ClO-.达平衡后,要使HClO浓度增大,可加入( )
| A、H2S |
| B、Na2CO3 |
| C、盐酸 |
| D、NaOH |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:反应Cl2+H2O?HCl+HClO达平衡后,要使HClO浓度增大,可以加入和盐酸反应的物质,据此分析解答.
解答:
解:A.向溶液中通入硫化氢,硫化氢和氯气发生氧化还原反应,导致平衡向逆反应方向移动,则次氯酸浓度降低,故A错误;
B.向溶液中加入Na2CO3,Na2CO3和稀盐酸反应导致平衡向正反应方向移动,次氯酸和Na2CO3不反应,所以次氯酸浓度增大,故B正确;
C.加入HCl,HCl的浓度增大,使平衡向逆反应方向移动,则次氯酸浓度降低,故C错误;
D.向溶液中加入NaOH,NaOH和HCl、HClO都反应,所以导致HClO浓度降低,故D错误;
故选B.
B.向溶液中加入Na2CO3,Na2CO3和稀盐酸反应导致平衡向正反应方向移动,次氯酸和Na2CO3不反应,所以次氯酸浓度增大,故B正确;
C.加入HCl,HCl的浓度增大,使平衡向逆反应方向移动,则次氯酸浓度降低,故C错误;
D.向溶液中加入NaOH,NaOH和HCl、HClO都反应,所以导致HClO浓度降低,故D错误;
故选B.
点评:本题考查了弱电解质的电离,根据物质性质确定平衡移动方向,从而确定次氯酸浓度变化,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、7gCnH2n中含有的氢原子数目为NA |
| B、18gD2O中含有的质子数目为10NA |
| C、标准状况下,22.4LCHCl3中含有氯原子数目为3NA |
| D、1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA |
下列各有机化合物的命名正确的是( )
| A、CH2═CH-CH═CH2 1,3二丁烯 |
B、 3-丁醇 3-丁醇 |
C、 3,4,4-三甲基己烷 3,4,4-三甲基己烷 |
D、 2-甲基丁烷 2-甲基丁烷 |
已知反应a R2O72-+x M2++14H+=b R3++x M3++c H2O,则系数x的值是( )
| A、3 | B、4 | C、5 | D、6 |
下列叙述错误的是( )
| A、配制FeCl3溶液,为了抑制水解,常加盐酸 |
| B、盐类都能水解 |
| C、盐类水解反应通常为吸热反应 |
| D、盐类水解是指组成盐的离子跟水电离出的H+或OH-离子生成弱电解质的反应 |
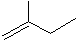 表示的分子式是
表示的分子式是