题目内容
15.某化学兴趣小组为了探究锌与硫酸反应的产物,选用了12mol/L的硫酸50mL与过量的锌在加热条件下反应,对硫酸的还原产物进行确定检验.(1)提出假设.根据所学的知识,他们对硫酸的还原产物提出了三种假设:
假设1:有SO2放出;
假设2:有H2放出;
假设3:有SO2与H2两种气体.
(2)设计实验方案证明假设.小组为了证明假设3,选用了如图所示的仪器与药品,按气流由左至右的方向,仪器的接口顺序为a→f→g→d→e→b→c→h(填字母,仪器与药品可重复使用).
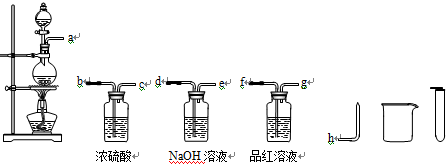
(3)实验结论.通过上述实验,证明确有SO2与H2两种气体产生的实验现象是品红溶液褪色证明含二氧化硫气体,玻璃弯管点燃气体出现淡蓝色火焰,火焰上方罩上干燥的烧杯,内壁有水生成证明生成了氢气,请你从理论上给予合理的解释:浓硫酸具有强氧化性加热条件和锌反应生成二氧化硫气体,随反应进行,浓硫酸浓度变化为稀硫酸,和锌发生置换反应生成氢气.
(4)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反
应后过滤,得到81.55g沉淀.则在该实验中生成的SO2气体在标准状态下的体积是5.6L.
分析 (1)浓硫酸和过量的锌加热反应生成二氧化硫气体,随反应进行浓硫酸变化为稀硫酸,和锌反应生成氢气,依据假设得到可能生成气体的成分;
(2)证明假设3有SO2与H2两种气体,先用品红溶液验证生成二氧化硫,在通过氢氧化钠溶液除去二氧化硫,通过浓硫酸干燥气体最后通过点燃检验氢气的生成;
(3)12mol/L的硫酸50mL与过量的锌在加热条件下反应,开始浓硫酸的强氧化性能氧化锌反应生成硫酸锌、二氧化硫和水,随反应进行,浓硫酸浓度变化为稀硫酸,和锌发生置换反应生成氢气,二氧化硫使品红溶液褪色,氢气检验利用其燃烧产生蓝色火焰验证;
(4)加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀为硫酸钡沉淀,计算其物质的量n(BaSO4)=n(SO42-)=n(H2SO4)=$\frac{81.55g}{233g/mol}$=0.35mol,12mol/L的硫酸50mL中含硫酸总物质的量=12mol/L×0.050L=0.6mol,则生成二氧化硫的硫酸为0.6,mol-0.35mol=0.25mol,据此计算二氧化硫气体体积;
解答 解:(1)浓硫酸和过量的锌加热反应生成二氧化硫气体,随反应进行浓硫酸变化为稀硫酸,和锌反应生成氢气,依据假设得到可能生成气体的成分,硫酸的还原产物提出了三种假设为:假设1:有二氧化硫气体放出,假设2:有氢气放出,假设3:有SO2与H2两种气体,
故答案为:有SO2放出;有H2放出;
(2)证明假设3有SO2与H2两种气体,先用品红溶液验证生成二氧化硫,在通过氢氧化钠溶液除去二氧化硫,通过浓硫酸干燥气体最后通过点燃检验氢气的生成,装置按气流由左至右的方向,仪器的接口顺序为a→f→g→d→e→b→c→h,
故答案为:f→g→d→e→b→c→h;
(3)12mol/L的硫酸50mL与过量的锌在加热条件下反应,开始浓硫酸的强氧化性能氧化锌反应生成硫酸锌、二氧化硫和水,随反应进行,浓硫酸浓度变化为稀硫酸,和锌发生置换反应生成氢气,通过上述实验,证明确有SO2与H2两种气体产生的实验现象是:品红溶液褪色证明含二氧化硫气体,玻璃弯管点燃气体出现淡蓝色火焰,火焰上方罩上干燥的烧杯,内壁有水证明生成了氢气,
故答案为:品红溶液褪色证明含二氧化硫气体,玻璃弯管点燃气体出现淡蓝色火焰,火焰上方罩上干燥的烧杯,内壁有水证明生成了氢气;浓硫酸具有强氧化性加热条件和锌反应生成二氧化硫气体,随反应进行,浓硫酸浓度变化为稀硫酸,和锌发生置换反应生成氢气;
(4)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀为硫酸钡沉淀,计算其物质的量n(BaSO4)=n(SO42-)=n(H2SO4)=$\frac{81.55g}{233g/mol}$=0.35mol,12mol/L的硫酸50mL中含硫酸总物质的量=12mol/L×0.050L=0.6mol,则生成二氧化硫的硫酸为0.6,mol-0.35mol=0.25mol,据此计算标准状况下二氧化硫气体体积=0.25mol×22.4L/mol=5.6L,
故答案为:5.6;
点评 本题考查了化学反应错误的实验探究和实验验证,主要是仪器连接、反应现象和生成气体的检验方法,掌握实验基础和物质性质是解题关键,题目难度中等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案
| A. | 苯氧乙酸的分子式为C8H8O3 | |
| B. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| C. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| D. | 步骤(2)产物中残留的烯丙醇可用溴水检验 |
| A. | 氯水配制 | B. | 塑料老化 | C. | 牛奶变质 | D. | 金属锈蚀 |
| A. | 水和重水 | B. | 氧气和臭氧 | ||
| C. | 2-甲基丁烷和新戊烷 | D. | 氘和氚 |
| A. | 该溶液的pH可能为2 | |
| B. | 若该溶液中的溶质只有一种,它可能是酸、碱或盐 | |
| C. | 向该溶液中加入铝片一定有氢气产生 | |
| D. | HSO3-、HS-、HPO42-等离子在该溶液中不能大量共存 |
| A. | H2S | B. | HNO3 | C. | H2SO4 | D. | H2SO3 |
 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是HCl,Y是蒸馏水 | B. | X是CO2,Y是稀H2SO4 | ||
| C. | X是SO2,Y是NaOH溶液 | D. | X是NH3,Y是NaNO3溶液 |
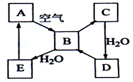 如图表示某固态单质A(淡黄色)及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A(淡黄色)及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.