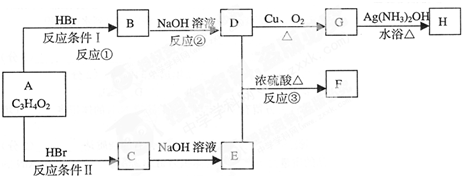
题目内容
新型超铁电池的电极材料A是仅由K、Fe、O三种元素组成的暗紫色化合物,具有强氧化性.在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质.为探究其成分,某学习兴趣小组的同学取化合物A粉末进行如图实验:

根据上述实验过程回答下列问题:
(1)化合物A的化学式为 ;气体单质B的分子式为 .
(2)化合物A与H2O反应的化学方程式为: .
(3)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展.下列物质中有可能提高化合物A水溶液稳定性的是 .
A.苯酚 B.KOH C.亚硫酸钠 D.Fe(NO3)3
(4)制备化合物A有多种方法:

①工业上常用电解法.装置如图1,其中铁片作阳极,KOH溶液作为电解质溶液,写出阳极的电极反应式: .
②实验室以次氯酸盐和氢氧化铁为原料,在强碱条件下制备少量A.如图2为制备次氯酸钾强碱性饱和溶液的装置图,反应过程中和保存饱和次氯酸钾中用冷水浴冷却的原因是 ,写出合成高铁酸钾的离子方程式: .

根据上述实验过程回答下列问题:
(1)化合物A的化学式为
(2)化合物A与H2O反应的化学方程式为:
(3)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展.下列物质中有可能提高化合物A水溶液稳定性的是
A.苯酚 B.KOH C.亚硫酸钠 D.Fe(NO3)3
(4)制备化合物A有多种方法:

①工业上常用电解法.装置如图1,其中铁片作阳极,KOH溶液作为电解质溶液,写出阳极的电极反应式:
②实验室以次氯酸盐和氢氧化铁为原料,在强碱条件下制备少量A.如图2为制备次氯酸钾强碱性饱和溶液的装置图,反应过程中和保存饱和次氯酸钾中用冷水浴冷却的原因是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)红棕色粉末为氧化铁,不含结晶水的盐为硫酸钾,根据数据计算出A中仅含有O、K、Fe三种元素的个数比,即得A的化学式;A不稳定,生成的红褐色沉淀为氢氧化铁,气体单质只能是氧气;
(2)K2FeO4中铁元素化合价为+6价,价态高,+6价的Fe元素易得电子表现出强氧化性,据此写出即可;
(3)根据提给信息:在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定等分析如何提高A水溶液稳定性;
(4)已知反应物和生成物,书写方程式时要根据原子守恒和电荷守恒.
(2)K2FeO4中铁元素化合价为+6价,价态高,+6价的Fe元素易得电子表现出强氧化性,据此写出即可;
(3)根据提给信息:在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定等分析如何提高A水溶液稳定性;
(4)已知反应物和生成物,书写方程式时要根据原子守恒和电荷守恒.
解答:
解:(1)红棕色固体粉末为氧化铁,3.96g化合物A含铁:
×2=0.02mol,含钾:
×2-0.08mol=0.04mol,
含氧:
=0.08mol,钾、铁、氧的个数比为:0.04mol:0.02mol:0.08mol=2:1:4,故A的化学式为:K2FeO4;高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,
故答案为:K2FeO4;O2;
(2)高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为:4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,
故答案为:4K2FeO4+10H2O=4Fe(OH)3↓+3O2↑+8KOH;
(3)A.亚硫酸钠具有还原性,会被高铁酸钾氧化,故A错误;
B.高铁酸钾在碱性条件下生成,故B正确;
C.高铁酸钾在水溶液中不稳定,与酸反应,故C错误;
D.在常温和干燥的条件下,高铁酸钾可以稳定的存在,但它在水溶液中不稳定,故D错误;
故答案为:B;
(4)①铁失去电子,在碱性溶液中生成高铁酸根离子,同时有水生成,阳极反应为Fe-6e-+8OH-═FeO42-+4H2O,故答案为:Fe-6e-+8OH-═FeO42-+4H2O;
②如图2为制备次氯酸钾强碱性饱和溶液的装置图,反应过程中和保存饱和次氯酸钾中用冷水浴冷却,防止温度升高时,反应生成氯酸钾(6KOH+3Cl2
5KCl+KClO3+3H2O),降低了次氯酸钾的产量;合成高铁酸钾的离子方程式:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
故答案为:防止温度升高时,反应生成氯酸钾(6KOH+3Cl2
5KCl+KClO3+3H2O),降低了次氯酸钾的产量;2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
| 1.6g |
| 160g/mol |
| 10.44g |
| 174g/mol |
含氧:
| 3.96g-0.02mol×56g/mol-0.04×39g/mol |
| 16g/mol |
故答案为:K2FeO4;O2;
(2)高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为:4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,
故答案为:4K2FeO4+10H2O=4Fe(OH)3↓+3O2↑+8KOH;
(3)A.亚硫酸钠具有还原性,会被高铁酸钾氧化,故A错误;
B.高铁酸钾在碱性条件下生成,故B正确;
C.高铁酸钾在水溶液中不稳定,与酸反应,故C错误;
D.在常温和干燥的条件下,高铁酸钾可以稳定的存在,但它在水溶液中不稳定,故D错误;
故答案为:B;
(4)①铁失去电子,在碱性溶液中生成高铁酸根离子,同时有水生成,阳极反应为Fe-6e-+8OH-═FeO42-+4H2O,故答案为:Fe-6e-+8OH-═FeO42-+4H2O;
②如图2为制备次氯酸钾强碱性饱和溶液的装置图,反应过程中和保存饱和次氯酸钾中用冷水浴冷却,防止温度升高时,反应生成氯酸钾(6KOH+3Cl2
| ||
故答案为:防止温度升高时,反应生成氯酸钾(6KOH+3Cl2
| ||
点评:本题考查学生阅读题目获取信息的能力、计算能力、设计实验能力等,题目较难,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

练习册系列答案
相关题目
下列物质为纯净物的是( )
| A、冰醋酸 | B、医用酒精 |
| C、福尔马林 | D、汽油 |
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为( )
| A、C+H2O═CO+H2 △H═+131.3KJ?mol-1 |
| B、C(s)+H2O(g)═CO(g)+H2(g)△H=+10.94KJ?mol-1 |
| C、C(s)+H2O(l)═CO(g)+H2(g)△H=+131.3KJ?mol-1 |
| D、C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ?mol- |