题目内容
18.下列金属中,通常采用热还原法冶炼的是( )| A. | 钠 | B. | 铁 | C. | 银 | D. | 金 |
分析 金属的冶炼一般有电解法、热还原法、热分解法、物理分离法
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得,
物理分离法:Pt、Au用物理分离的方法制得.
解答 解:A.钠性质活泼用电解法制取,故A不选;
B.铁性质较活泼用热还原反应制取,故B选;
C.银性质稳定用热分解氧化物法制取,故C不选;
D.金性质不活泼,用物理分离的方法制得,故D不选;
故选:B.
点评 本题考查金属冶炼的一般方法和原理,明确金属的活泼性是解题关键,题目难度不大.

练习册系列答案
相关题目
8.(1)下表示元素周期表的一部分
①写出元素符号:fSi;hCl;
②c、d、e、b的原子半径由大到小的顺序是Na>Mg>Al>F;
③g、h的最高价氧化物的水化物中酸性强的是HClO4;
④a、f的氢化物中稳定性强的是SiH4.
⑤a元素和氢元素形成的化合物的电子式是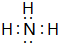 .
.
⑥c元素和b元素形成的化合物中含有的化学键类型是离子键.
(2)下表是元素周期表的一个片段,各元素均属于短周期元素

①若X的单质为空气的主要成分之一,则W的原子结构示意图 ;
;
②若Y能与钠形成反应生成淡黄色固体,则该淡黄色固体的化学式为Na2O2;含有的化学键类型有离子键、共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i |
②c、d、e、b的原子半径由大到小的顺序是Na>Mg>Al>F;
③g、h的最高价氧化物的水化物中酸性强的是HClO4;
④a、f的氢化物中稳定性强的是SiH4.
⑤a元素和氢元素形成的化合物的电子式是
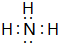 .
.⑥c元素和b元素形成的化合物中含有的化学键类型是离子键.
(2)下表是元素周期表的一个片段,各元素均属于短周期元素

①若X的单质为空气的主要成分之一,则W的原子结构示意图
 ;
;②若Y能与钠形成反应生成淡黄色固体,则该淡黄色固体的化学式为Na2O2;含有的化学键类型有离子键、共价键.
9.正丁烷的一氯代物有几种( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
13.下列叙述错误的是( )
| A. | 吸热反应的反应物总能量低于生成物总能量 | |
| B. | 绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 | |
| C. | 电力属于一次能源 | |
| D. | 物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
3.在溶液中含有的物质至少有( )
| A. | 一种 | B. | 两种 | C. | 三种 | D. | 四种 |
10.在①钾盐 ②铵盐 ③硝酸盐 ④硫酸盐 ⑤盐酸盐 ⑥碳酸盐中,均能溶于水的一组盐是( )
| A. | ①②⑤ | B. | ②③④ | C. | ①②③ | D. | ①③⑥ |

 和
和