题目内容
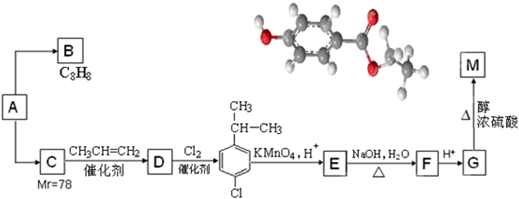
13.有机化学反应因条件不同,可生成不同的产物.例如: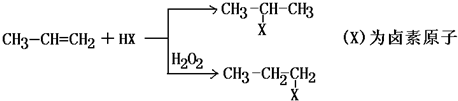
已知:

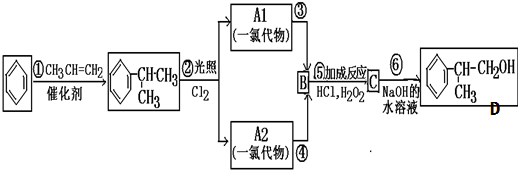
提示:苯的同系物与Cl2在光照条件下反应发生的是侧链取代.
请回答下列问题:
(1)反应①的反应类型:加成反应;
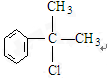
(2)写出A1、A2可能的结构简式:
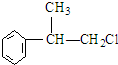 ,
,
(3)B的结构简式:
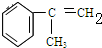 C的结构简式:
C的结构简式: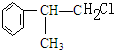 .
.(4)反应⑤的化学方程式:
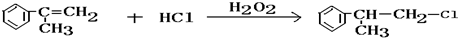 .
.(5)与D的碳架结构相同且含有羟基的同分异构体有多种.任意写出其中一种
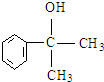 等.
等.
分析 苯和丙烯在催化剂条件下反应生成异苯丙烷,异苯丙烷在光照条件下和氯气发生取代反应生成A1和A2,A是一氯代物,则支链上取代位置可能是甲基也可能是次甲基,A的结构简式可能是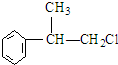 或
或 ,
,
A反应生成B,B和氯化氢发生加成反应生成C,则A发生消去反应生成B,B的结构简式为: ,C是氯代烃,C发生水解反应生成D,根据D结构简式知,C的结构简式为:
,C是氯代烃,C发生水解反应生成D,根据D结构简式知,C的结构简式为: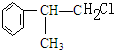 ,据此分析解答.
,据此分析解答.
解答 解:苯和丙烯在催化剂条件下反应生成异苯丙烷,异苯丙烷在光照条件下和氯气发生取代反应生成A1和A2,A是一氯代物,则支链上取代位置可能是甲基也可能是次甲基,A的结构简式可能是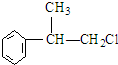 或
或 ,
,
A反应生成B,B和氯化氢发生加成反应生成C,则A发生消去反应生成B,B的结构简式为: ,C是氯代烃,C发生水解反应生成D,根据D结构简式知,C的结构简式为:
,C是氯代烃,C发生水解反应生成D,根据D结构简式知,C的结构简式为: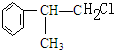 ,
,
(1)通过以上分析知,反应①的反应类型是加成反应,故答案为:加成反应;
(2)A的结构简式可能是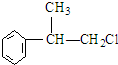 或
或 ,
,
故答案为: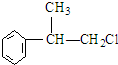 ;
; ;
;
(3)B、C结构简式分别为 、
、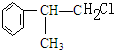 ,故答案为:
,故答案为: ;
;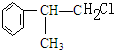 ;
;
(4)该反应方程式为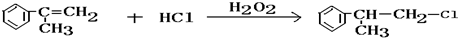 ,
,
故答案为: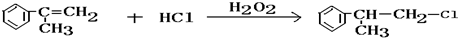 ;
;
(5)D是 ,与D的碳架结构相同且含有羟基的同分异构体就是将羟基位置进行移动,可得4种同分异构体,有
,与D的碳架结构相同且含有羟基的同分异构体就是将羟基位置进行移动,可得4种同分异构体,有 等,
等,
故答案为: 等.
等.
点评 本题考查了有机物的推断,明确有机物的官能团、性质及其反应条件是解本题关键,反应物相同条件不同导致产物不同,方程式和同分异构体的书写是常考查点,侧重考查学生分析判断能力.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
4.甲与乙在敞口容器里的溶液中的转化关系如图所示,甲不可能是( )
甲$\stackrel{OH-}{→}$乙$\stackrel{H+}{→}$甲.
甲$\stackrel{OH-}{→}$乙$\stackrel{H+}{→}$甲.
| A. | Fe2+ | B. | Al | C. | HCO${\;}_{3}^{-}$ | D. | CO2 |
8.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. |  实验室制取乙烯 | B. | 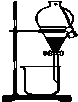 利用酒精萃取碘水中的I2单质 | ||
| C. | 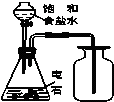 实验室制取乙炔并收集 | D. | 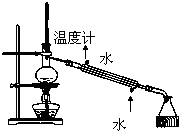 石油的分馏实验 |
5.已知反应A(g)+3B(g)?2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
2.(1)CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标.250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g)
①此温度下该反应的平衡常数表达式K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1kJ•mol-1;
(2)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H<0 (填“>”、“=”或“<”).
②300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
①此温度下该反应的平衡常数表达式K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1kJ•mol-1;
(2)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
3.如图所示的装置可用于( )


| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
 .
.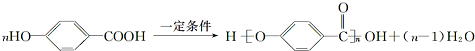 .
.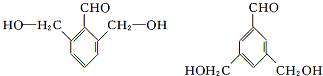 (任意一种).
(任意一种).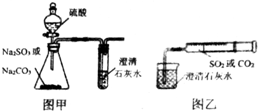 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.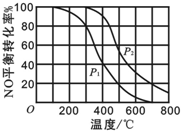 (1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.
(1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.