题目内容
3.在一体积不变的密闭容器中进行如下反应:2X(g)+Y(g)?2W(g);反应前按n(X):n(Y)=3:1加入反应物,反应过程中W的物质的量随时间的变化如图所示.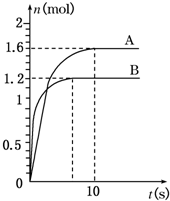
(1)分析曲线A和B的不同,可能是以下B原因造成的.
A.是否使用催化剂 B.反应温度不同
C.外界的压强不同 D.初始充入的反应物的物质的量不同
(2)该反应的化学平衡常数为K,比较K500℃>K600℃(填“>”、“<”或“=”).
(3)如果曲线B达到平衡时,体系的压强为反应前的85%,当容器的体积为1L时,计算:曲线A从开始达到平衡,X的反应速率v(X)为_0.16 mol•L-1•s-1.起始时加入Y的物质的量为1mol.不通过计算能否判断出X、Y转化率是否相同能(填“能”或“否”).
(4)说明该反应已达到平衡状态的是AC.
A.v正(W)=v逆(W) B.c(X)=c(W)
C.气体的平均摩尔质量不变 D.气体的密度保持不变.
分析 (1)A.使用催化剂不改变平衡状态;
B.先拐先平衡,则反应温度B高,但平衡时W的物质的量较少,所以升温平衡逆向移动;
C.先拐先平衡,则反应压强B高,升压平衡正向移动,则平衡时W的物质的量较多;
D.先拐先平衡,则反应开始充入的反应物的物质的量B多,则平衡时W的物质的量也较多;
(2)由(1)得出该反应该平衡为放热反应,所以升温平衡逆向移动,据此判断K500℃和K600℃;
(3)根据图象曲线A从开始达到平衡,生成W为1.6mol,所以消耗X也为1.6mol,则根据的反应速率v(X)=$\frac{△c}{△t}$计算;根据如果曲线B达到平衡时,体系的压强为反应前的85%,列三段式计算起始时加入Y的物质的量;根据开始加入的n(X):n(Y)=3:1以及按照2:1进行反应判断出X、Y转化率是否相同;
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)A.使用催化剂不改变平衡状态,故A错误;
B.先拐先平衡,则反应温度B高,但平衡时W的物质的量较少,所以升温平衡逆向移动,则该平衡为放热反应,故B正确;
C.先拐先平衡,则反应压强B高,升压平衡正向移动,则平衡时W的物质的量较多,与图象不符合,故C错误;
D.先拐先平衡,则反应开始充入的反应物的物质的量B多,则平衡时W的物质的量也较多,与图象不符合,故D错误;
故选:B;
(2)由(1)得出该反应该平衡为放热反应,所以升温平衡逆向移动,所以温度高平衡常数小,则K500℃>K600℃;故答案为:>;
(3)2X(g)+Y(g)?2W(g),设起始时加入Y的物质的量为amol,则X为3amol;
开始 3a a 0
反应 1.2 0.6 1.2
平衡3a-1.2 a-0.6 1.2
所以反应速率v(X)=$\frac{△c}{△t}$=$\frac{\frac{1.6}{1}}{10}$=0.16 mol•L-1•s-1;
$\frac{4a-0.6}{4a}$=85%,解得a=1mol,
因为n(X):n(Y)=3:1加入反应物,反应按照2:1进行,所以转化率不相同;
故答案为:0.16 mol•L-1•s-1;1; 能;
(4)A.v正(W)=v逆(W),正逆反应速率相等,能判断平衡,故A正确;
B.c(X)=c(W)未体现正与逆的关系,故B错误;
C.反应前后质量不变,气体物质的量在变化,所以气体的平均摩尔质量不变能判断平衡,故C正确;
D.反应前后质量不变,体积不变,气体的密度始终保持不变,故D错误;
故选AC.
点评 本题考查了化学平衡图象的分析、反应速率的计算以及平衡状态的判断,难度不大,注意计算三段式的应用.

 口算题天天练系列答案
口算题天天练系列答案| A. | 通惰性气体增大压强,平衡正向移动 | |
| B. | 再加入X,反应吸收的热量增大 | |
| C. | 增加Y的物质的量,X的转化率减小 | |
| D. | 降低温度,c(Y):c(Z)的值变小 |
| A. | m+n<p | B. | C的体积分数下降 | ||
| C. | 平衡向逆反应反向移动 | D. | A的转化率变大 |
| A. | Na+ K+ SO42- HCO3- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+Cl- NO3- | D. | Fe3+ K+ SO42- Cl- |
| 化学反应 | 催化剂 | Ea/KJ•mol-1 | k(催)/k(无) | |
| 无催化剂 | 有催化剂 | |||
| C12H22O11(蔗糖)+H2O═ C6H12O6 (葡萄糖)+C6H12O6(果糖) | 蔗糖酶 | 107 | 36 | 9.2×1011(310K) |
| 2HI═H2+I2 | 金 | 184 | 105 | 1.6×108(503K) |
| CH3CHO═CH4+CO | 碘 | 210 | 136 | 7.5×104(793K) |
| 2H2O2═2H2O+O2 | 过氧化氢酶 | 75 | 25 | 5.8×108(298K) |
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
 苯甲酸的分子式为C6H5COOH,分子结构为
苯甲酸的分子式为C6H5COOH,分子结构为 ,是苯环上的一个氢被羧基(-COOH)取代形成的化合物.其化学性质与乙酸类似,具有弱酸性,并可以和乙醇发生酯化反应生成苯甲酸乙酯.
,是苯环上的一个氢被羧基(-COOH)取代形成的化合物.其化学性质与乙酸类似,具有弱酸性,并可以和乙醇发生酯化反应生成苯甲酸乙酯. +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O;实验中使用分水器的目的是分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;.
+H2O;实验中使用分水器的目的是分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;.