题目内容
2.关于吸热反应和放热反应,下列说法正确的是( )| A. | 需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 放热反应不需要加热即可发生 | |
| C. | 放热反应常温下易发生 | |
| D. | 反应是放热还是吸热,要看反应物和生成物所具有的总能量的相对大小,不能看反应条件 |
分析 A.反应是吸热还是放热与反应的条件无关;
B.放热反应也需要一定条件发生反应;
C.有些放热反应在常温条件不能发生反应,如铝热反应;
D.化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化,和反应条件无关;
解答 解:A.需加热才能发生的反应不一定是吸热反应,如铝热反应是放热反应,但在加热的条件下才能发生,故A错误;
B.放热反应也需要一定条件发生反应,如氢气和氧气需要点燃才能发生反应,故B错误;
C.有些放热反应在常温条件不能发生反应,如铝热反应是放热反应,但在加热的条件下才能发生,故C错误;
D.放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,和反应条件无关,故D正确;
点评 本题主要考查了化学反应中的能量变化、反应的类型与条件的关系,题目难度不大,注意能举例说明.

练习册系列答案
相关题目
7.苯乙酸的同分异构体中属于芳香酯类的有( )种.
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
14.下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是( )
| A. | 两者都具有丁达尔效应 | |
| B. | 分散质的粒子直径均在1~100nm之间 | |
| C. | 加烧碱溶液都会沉淀 | |
| D. | 前者是混合物,后者是纯净物 |
12.在C6H6、C8H8、C2H2O2组成的混合物中,已知氧元素的质量分数为9%,则混合物中碳元素的质量分数是( )
| A. | 92.3% | B. | 87.6% | C. | 75% | D. | 84% |
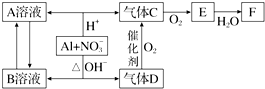
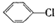 制备
制备 步骤:
步骤: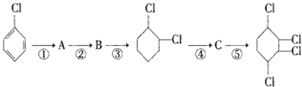
 ,B
,B ,C
,C
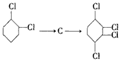 的化学方程式①
的化学方程式①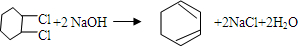 ②
②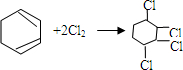 .
.


 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子) (写结构简式).
(写结构简式).