题目内容
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 50ml,12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| B. | 常温常压下4.4g乙醛所含σ键数目为0.7NA | |
| C. | 向浓H2SO4中通入H2S气体,1mol浓H2SO4转移电子数一定是2 NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
分析 A.二氧化锰只能与浓盐酸反应,和稀盐酸不反应;
B.求出乙醛的物质的量,然后根据1mol乙醛中含6molσ键来分析;
C.H2S+H2SO4(浓)═S↓+SO2+2H2O中,S元素的化合价由-2价升高为0,S元素的化合价由+6降低为+4价,也可能发生反应3H2SO4(浓)+H2S═4SO2+4H2O 向浓H2SO4中通入H2S气体,转移的电子数可能是6NA;
D.H218O与D2O的摩尔质量均为20g/mol,且H218O与D2O中均含10个中子;
解答 解:A.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,即盐酸不能反应完全,故转移的电子数小于0.3NA个,故A错误;
B.4.4g乙醛的物质的量=$\frac{4.4g}{44g/mol}$=0.1mol,而1mol乙醛中含6molσ键,故0.1mol乙醛中含0.6molσ键,即0.6NA个,故B错误;
C.H2S+H2SO4(浓)═S↓+SO2+2H2O中,S元素的化合价由-2价升高为0,S元素的化合价由+6降低为+4价,电子转移2NA,如发生反应3H2SO4(浓)+H2S═4SO2+4H2O 向浓H2SO4中通入H2S气体,转移的电子数可能是6NA,因为H2S中S元素由-2价升高到+4价,化合价升高了6价,转移的电子数可能是6NA,故C错误;
D.H218O与D2O的摩尔质量均为20g/mol,故2.0g混合物的物质的量为0.1mol,而且H218O与D2O中均含10个中子,故0.1mol混合物中含1mol中子即NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意二氧化锰只能与浓盐酸反应,和稀盐酸不反应,题目难度中等.

练习册系列答案
相关题目
3. 扁桃体酸衍生物可用于生化研究,其结构简式如图.下列关于扁桃体酸衍生物的叙述确的是( )
扁桃体酸衍生物可用于生化研究,其结构简式如图.下列关于扁桃体酸衍生物的叙述确的是( )
 扁桃体酸衍生物可用于生化研究,其结构简式如图.下列关于扁桃体酸衍生物的叙述确的是( )
扁桃体酸衍生物可用于生化研究,其结构简式如图.下列关于扁桃体酸衍生物的叙述确的是( )| A. | 分子中有1个手性碳原子 | |
| B. | 在空气中可以稳定存在 | |
| C. | 1mol扁桃体酸衍生物最多可与3molNaOH发生反应 | |
| D. | 扁桃体酸衍生物可发生取代、加成、消去等反应 |
9.有关下列反应的离子方程式书写正确的是( )
| A. | 稀盐酸与澄清石灰水反应:H++OH-═H2O | |
| B. | CaCO3与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| D. | CuSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ |
6.下列对有机化合物的说法错误的是( )
| A. | 煤的干馏、石油的分馏分别是化学变化、物理变化 | |
| B. | 棉花、蚕丝、合成纤维的主要成分都是纤维素 | |
| C. | 油脂可看做高级脂肪酸(如硬脂酸、软脂酸等)与甘油经酯化反应生成的酯 | |
| D. | 可以用新制的氢氧化铜悬浊液检验患者尿液中的葡萄糖 |
13.下列物质中,其主要成分不属于烃的是( )
| A. | 汽油 | B. | 生物柴油 | C. | 煤油 | D. | 润滑油 |
10.下列化合物的俗称与化学式不对应的是( )
| A. | 绿矾-FeSO4•7H2O | B. | 石膏-CaSO4•2H2O | ||
| C. | 明矾-Al2(SO4)3•12H2O | D. | 胆矾-CuSO4•5H2O |
8.在0.1mol•L-1NaHCO3与0.1mol•L-1NaOH等体积混合所得的溶液中,粒子的物质的量浓度关系不正确的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3) | B. | c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | ||
| C. | c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | D. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |

 .
.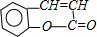 +H2O$\stackrel{酸}{→}$
+H2O$\stackrel{酸}{→}$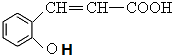 .
.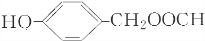 、
、 .
. 合成
合成