题目内容
6.下列说法正确的是( )| A. | 凡是放热反应都是自发的,凡是吸热反应都是非自发的 | |
| B. | 自发反应一定是放热反应,非自发反应一定是吸热反应 | |
| C. | 自发反应在恰当条件下才能实现 | |
| D. | 自发反应在任何条件下都能实现 |
分析 放热反应有利于反应的自发进行,熵增加的饭应有利于反应的自发进行,但是化学反应能否自发进行的判据是看△H-T△S是否小于零,以此解答该题.
解答 解:A.反应自发进行的判断依据是△H-T△S<0,放热反应也可能是非自发的,吸热反应也可能是自发的,故A错误;
B.氯化铵与氢氧化钡晶体的反应为吸热反应,但可自发进行,故B错误;
C.在恰当条件下,如满足△H-T△S<0,则可自发进行,故C正确;
D.有些自发进行的反应也需要反应条件,才能进行,如氢气和氧气需要点燃反应,故D错误.
故选C.
点评 本题考查了化学反应自发进行大判断依据和条件分析,为高频考点,侧重于学生的分析能力的考查,注意反应是否自发进行需要焓变、熵变、温度共同决定,题目难度不大.

练习册系列答案
相关题目
20.下列热化学方程式或离子方程式正确的是( )
| A. | 已知H2的燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 稀硫酸和Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ |
1.对于amolH2O和amolCO2的说法正确的是( )
| A. | 相同条件下体积一定相同 | B. | 氧原子个数一定相同 | ||
| C. | 分子个数一定相同 | D. | 质量比是22:9 |
11.某溶液中含有Ag+、Cu2+、Mg2+、Ba2+、Al3+等离子,要使这些离子逐一沉淀分离,所加试剂及顺序正确的是( )
| A. | H2SO4→HCl→K2S→NaOH→CO2 | B. | NaCl→Na2SO4→Na2S→NH3•H2O→HCl | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→HCl | D. | NaCl→Na2SO4→H2S→NaOH→CO2 |
18.为了确认电解质溶液中部分离子相互间能否发生反应,及离子反应发生的条件,做如表四组实验.
(1)实验Ⅰ的现象有白色沉淀产生,写出反应的离子方程式Ba++SO42+=BaSO4↓.
(2)实验Ⅱ的目的是验证Cl-与Cu2+不发生反应.
(3)实验Ⅲ的现象证明了溶液中的H+、OH-两种离子之间发生了化学反应.
(4)实验Ⅳ中发生反应的离子方程式是CaCO3+2H+═Ca2++CO2↑+H2O.
| 编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 实验 |  | 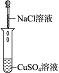 | 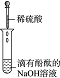 | 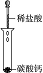 |
(2)实验Ⅱ的目的是验证Cl-与Cu2+不发生反应.
(3)实验Ⅲ的现象证明了溶液中的H+、OH-两种离子之间发生了化学反应.
(4)实验Ⅳ中发生反应的离子方程式是CaCO3+2H+═Ca2++CO2↑+H2O.
15.不可能是炔烃的加成产物的是( )
| A. | 乙烷 | B. | 异丁烷 | C. | 异戊烷 | D. | 2,3-二甲基戊烷 |
16. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4是N2的同素异形体 | |
| C. | N4分子中N-N键角为109°28′ | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
 。
。
 在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①-⑤中适当的物质,使有连线的两种物质能发生反应.
在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①-⑤中适当的物质,使有连线的两种物质能发生反应.