题目内容
7.关于碱金属单质的性质叙述正确的是( )| A. | 在空气中燃烧都能生成过氧化物 | |
| B. | 与盐酸溶液反应时都能生成碱和氢气 | |
| C. | 熔沸点随原子序数增加而升高 | |
| D. | 还原性随原子电子层数的增加而增加 |
分析 A.锂在空气中燃烧生成氧化锂,钾燃烧生成超氧化钾;
B.碱金属性质活泼,与盐酸溶液反应时都能生成盐和氢气;
C.金属晶体原子半径越大熔沸点越低;
D.碱金属原子半径越大,失去电子的能力越强,金属性越强,单质还原性越强.
解答 解:A.锂在空气中燃烧生成氧化锂,钾燃烧生成超氧化钾,故A错误;
B.碱金属性质活泼,与盐酸溶液反应时都能生成盐和氢气,而不是碱,故B错误;
C.碱金属随原子序数增加,原子半径增大,金属键越弱,熔沸点越低,故C错误;
D.碱金属随原子序数增加,电子层数的增加,失去电子的能力越强,金属性越强,单质还原性越强,故D正确;
故选:D.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的递变规律是解题的关键,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
18.下列各组反应中,属于可逆反应的一组是( )
| A. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| B. | NH3+CO2+H2O═NH4HCO3,NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O↑+CO2↑ | |
| C. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI,2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+I2↑ | |
| D. | 2Ag+Br2$\frac{\underline{\;CuO\;}}{\;}$2AgBr,2AgBr$\frac{\underline{\;光\;}}{\;}$2Ag+Br2 |
15.下列化合物中既含离子键又含共价键的是( )
| A. | 硫酸 | B. | 氯化镁 | C. | 氢氧化钡 | D. | 二氧化碳 |
2.下列叙述中,正确的是( )
| A. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 | |
| B. | 实验室制取氯气时,常用饱和石灰水来吸收多余的氯气 | |
| C. | 漂白粉中含有次氯酸,所以漂白粉能使染料有机色素褪色 | |
| D. | 氯气可用于自来水消毒,因其反应产生次氯酸能杀死细菌 |
19.某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63.下列叙述中错误的是( )
| A. | 它是第Ⅷ族元素 | |
| B. | 它是第六周期元素 | |
| C. | 它属于过渡元素 | |
| D. | 它的某种同位素核内中子数大于质子数 |
17.下列说法正确的是( )
| A. | ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含共价键的离子化合物 | |
| B. | 在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 | |
| C. | HI的相对分子质量比HF大,所以HI的沸点比HF高 | |
| D. | H与D、16O与18O互为同位素;H216O、D216O、H218O、D216O互为同素异形体 |
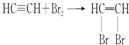
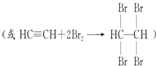
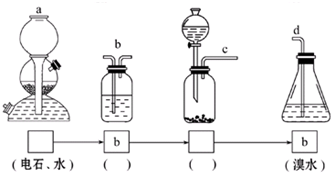
 .
.