题目内容
将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为 .
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:此题为溶液PH的计算,涉及两种题型,一种为溶液的稀释,另一种为酸碱溶液的混合,计算时前者根据溶质的物质的量不变,后者计算反应后剩余的酸的物质的量和溶液的体积进行计算.由稀释规律知,1份pH=1的盐酸升高pH=2时所加水应该约为9份;设加NaOH溶液x份,则盐酸与NaOH溶液(据题意知其浓度应为0.1 mol?L-1)反应后仍有盐酸剩余,即得加入的水与NaOH溶液的体积比.
解答:
解:根据题意盐酸平均分成2份,设每份都为1L,将pH=l的盐酸加适量的水,pH升高了1,则体积是原盐酸体积的10倍,说明所加的水的体积是原溶液的9倍,即水的体积为9L;
另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1.可设碱液体积x.依题意可列出下列等式:10-1mol/L×1L-10-1mol/L×xL=10-2mol/L×(1+x)L,
解之得x=
L,则加入的水与NaOH溶液的体积比为9:
=11:1,
故答案为:11:1;
另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1.可设碱液体积x.依题意可列出下列等式:10-1mol/L×1L-10-1mol/L×xL=10-2mol/L×(1+x)L,
解之得x=
| 9 |
| 11 |
| 9 |
| 11 |
故答案为:11:1;
点评:本题是关于pH的计算,综合性强,涉及溶液的稀释和酸碱中和后混合液的pH计算,题目难度中等,解题的关键是概念清楚、公式准确,根据题意求解,在熟练掌握基础知识的同时,还应根据题目的要求,灵活运用,解决实际问题.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
下列有关实验原理、装置、操作或结论的描述中,正确的是( )
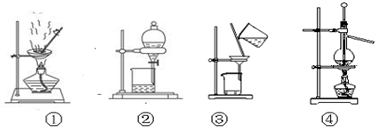

| A、用图①装置蒸发稀盐酸制浓盐酸 |
| B、用图②装置分液时,下层液体从分液漏斗下口放出,关闭活塞再将上层液体从上口倒出 |
| C、用图③洗涤沉淀时,漏斗中加入适量蒸馏水,搅拌并滤干 |
| D、用图④装置,分离四氯化碳与苯的混合溶液 |
 在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法错误的是( )
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法错误的是( )| A、NO2是红棕色气体 | ||||
| B、NO和O2必须在催化剂表面才能反应 | ||||
| C、汽车尾气的主要污染成分包括CO和NO | ||||
D、催化转化总反应为:2NO+O2+4CO
|
W克下列物质电火花引燃后的产物通过足量的Na2O2后,固体增重大于W克的是( )
| A、CO与H2的混合气体 |
| B、CH3CH2OH |
| C、HCOOH |
| D、CH3COOH |

 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示. 