题目内容
12.下列叙述中,错误的是( )| A. | SiO2是硅酸的酸酐,但不能由SiO2直接制硅酸 | |
| B. | 二氧化硅是通讯材料光导纤维的主要原料 | |
| C. | 氧化铝陶瓷、碳化硅陶瓷都是重要的高温结构陶瓷 | |
| D. | 二氧化硅熔点与干冰相差不大,它们都是酸性氧化物 |
分析 A、二氧化硅是不溶于水的氧化物;
B、光导纤维的主要原料为二氧化硅;
C、氧化铝陶瓷和氮化硅陶瓷中的氧化铝和氮化硅熔点高,耐高温;
D、二氧化硅是原子晶体,而二氧化碳是分子晶体.
解答 解:A、二氧化硅是不溶于水的氧化物,硅酸不能由SiO2直接制得,故A正确;
B、光导纤维的主要原料为二氧化硅,故B正确;
C、氧化铝陶瓷和氮化硅陶瓷中的氧化铝和氮化硅熔点高,耐高温,属于高温结构陶瓷,故C正确;
D、二氧化硅是原子晶体,而二氧化碳是分子晶体,两者熔点相差很大,故D错误;
故选D.
点评 本题考查学生二氧化硅的性质,注意二氧化硅是酸性氧化物,不溶于水,不能用二氧化硅制取硅酸,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
2.下列有关分类的说法正确的是( )
| A. | 胶体的本质特征是具有丁达乐效应 | |
| B. | 阳离子、阴离子中均分别只含有一种元素,则由这样的阴、阳离子组成的物质一定是纯净物 | |
| C. | 白磷转化为红磷是物理变化 | |
| D. | 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
3.下列各组中两种物质发生变化时,所克服的作用力属于同种类型的是( )
| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 碘和干冰的升华 | D. | 氯化钠和氯化氢溶于水 | ||
| E. | 硅和蔗糖的熔化 | F. | 酒精和水的挥发 |
20.将一定质量的锌、氧化铁、氧化铜的混合物粉末放入100mL4.4mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质锌的质量是( )
| A. | 2.60g | B. | 3.90g | C. | 6.50g | D. | 13.65g |
7.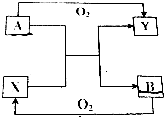 已知A、B、X、Y四种常见物质(其中A、B为单质,X、Y为化合物)有如图所示的转化关系(反应条件已略去);则X不可能为( )
已知A、B、X、Y四种常见物质(其中A、B为单质,X、Y为化合物)有如图所示的转化关系(反应条件已略去);则X不可能为( )
 已知A、B、X、Y四种常见物质(其中A、B为单质,X、Y为化合物)有如图所示的转化关系(反应条件已略去);则X不可能为( )
已知A、B、X、Y四种常见物质(其中A、B为单质,X、Y为化合物)有如图所示的转化关系(反应条件已略去);则X不可能为( )| A. | CO2 | B. | H2O | C. | Fe3O4 | D. | SO3 |
4.下列叙述正确的是( )
| A. | 镁铝合金的抗腐蚀能力强,不与稀硫酸反应 | |
| B. | Na的金属活动性比Mg的强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 钠可与冷水剧烈反应,而镁与热水才能反应,说明钠比镁活泼 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中,Fe也显+3价 |
11.下列物质①NaOH、②氯水、③空气、④氢硫酸、⑤Na2SO3、⑥Na2CO3,其中能与SO2在一定条件下发生反应的是( )
| A. | ①②④⑤ | B. | ②④⑤⑥ | C. | ②③④⑤ | D. | 全部 |
9.氧化铁是一种红色的颜料,在工业上常以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程如下:
废液$→_{①}^{提纯、结晶}$FeSO4•7HO2$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2CO3
已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
若从硫酸亚铁溶液中结晶出FeSO4•7H2O,控制的温度(t)为t<56.7℃;
(1)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解;
(2)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(3)FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
(4)已知FeSO4•7H2O晶体在加热条件下发生反应,其中一种生成物会用于涂料中的着色剂.请写出
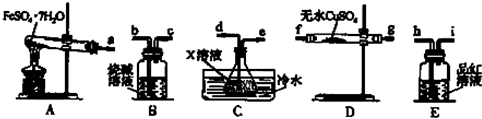
FeSO4•7H2O分解的反应式FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.
请填写下列空白:
①仪器的连接顺序为a 接f(或g)、g(或f)接d、e接h、i接b;
②装置C中的X为氯化钡溶液.
废液$→_{①}^{提纯、结晶}$FeSO4•7HO2$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2CO3
已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(1)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解;
(2)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(3)FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
(4)已知FeSO4•7H2O晶体在加热条件下发生反应,其中一种生成物会用于涂料中的着色剂.请写出
FeSO4•7H2O分解的反应式FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.

请填写下列空白:
①仪器的连接顺序为a 接f(或g)、g(或f)接d、e接h、i接b;
②装置C中的X为氯化钡溶液.
