题目内容
11.下列与化学反应能量变化相关的叙述正确的是( )| A. | 甲烷可用作燃料,说明甲烷燃烧是释放能量的反应 | |
| B. | 生成物总能量一定低于反应物总能量 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
分析 A、燃烧都是放热反应;
B、焓变等于生成物能量与反应能量差;
C、干冰气化是物理变化;
D、焓变与反应条件无关.
解答 解:A、燃烧都是放热反应,故A正确;
B、生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故B错误;
C、吸热反应是指化学反应,干冰气化是物理变化,故C错误;
D、根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关,在光照和点燃条件下该反应的△H相同,故D错误.
故选A.
点评 本题考查了焓变与反应条件无关、燃烧是放热反应、吸热反应和放热反应是指化学变化、焓变与反应条件无关,题目难度中等.

练习册系列答案
相关题目
9.海洋中有丰富的食品、矿产、能源、药物和水产资源.下图是从海水中提取某些原料的.
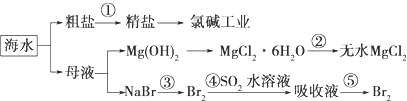
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液-→过滤后加盐酸 | |
| B. | 从第③步到第⑤步的目的是浓缩、富集溴 | |
| C. | 第①到第⑤步中,涉及到氧化还原反应共有2步 | |
| D. | 第④步中,SO2起氧化作用 |
2. 为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:
(1)下列由极性键形成的极性分子是C.
A.N2 B.O2 C.H2O D.CO2E.CH4
(2)下列说法不正确的是C.
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3.CHClFCF3.C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是D.
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的是ABD.
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4•46H2O)是在低温高压下形成的晶体
(5)中钴离子在基态时核外电子排布式为:1s22s22p63s23p63d6.
 为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:| 选项 | 物质 | 大气中的含量 (体积百分比) | 温室效应指数 |
| A | H2 | 2 | 0 |
| B | O2 | 21 | 0 |
| C | H2O | 1 | 0.1 |
| D | CO2 | 0.03 | 1 |
| E | CH4 | 2×10-4 | 30 |
| F | N2O | 3×10-5 | 160 |
| G | O3 | 4×10-5 | 2000 |
| H | CCl3F | 2.8×10-8 | 21000 |
| I | CCl2F2 | 4.8×10-4 | 25000 |
A.N2 B.O2 C.H2O D.CO2E.CH4
(2)下列说法不正确的是C.
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3.CHClFCF3.C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是D.
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的是ABD.
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4•46H2O)是在低温高压下形成的晶体
(5)中钴离子在基态时核外电子排布式为:1s22s22p63s23p63d6.
19.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 32克O2和O3组成的混合气体中含有的氧原子数目为2NA | |
| B. | 常温常压下,22.4 L乙醇含有的分子数目为NA | |
| C. | 1 mol Na变为Na+时得到的电子数目为NA | |
| D. | 44克14C16O2含氧原子数为2NA |
6.俄国化学家制出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑.这位化学家是( )
| A. | 汤姆生 | B. | 道尔顿 | C. | 拉瓦锡 | D. | 门捷列夫 |
16.不能用化学键的牢固程度解释的是( )
| A. | 金属Na熔沸点高于金属K | |
| B. | 非金属性N>P,但是单质活泼性:氮气<白磷 | |
| C. | 相同条件下,NH3在水中的溶解度大于PH3 | |
| D. | SiC晶体的熔点比晶体硅的高 |
3.下列金属一般用电解熔融盐的方法冶炼的是( )
| A. | K | B. | Cu | C. | Fe | D. | Ag |
20.下列营养素中,能为人体提供能量的是( )
| A. | 水 | B. | 糖类 | C. | 维生素 | D. | 无机盐 |
 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题: