题目内容
下列各组有机物,不管它们以何种比例混合,只要物质的量一定,则完全燃烧时消耗氧气为一定值的是( )
| A、C4H6、C3H8 |
| B、C5H10、C6H6 |
| C、C2H6O、C2H4O2 |
| D、C3H6、C3H8 |
考点:化学方程式的有关计算
专题:烃及其衍生物的燃烧规律
分析:不管它们以何种比例混合,只要物质的量一定,则完全燃烧时消耗氧气为一定值,设有机物为CxHyOz,则x+
-
相同,以此来解答.
| y |
| 4 |
| z |
| 2 |
解答:
解:不管它们以何种比例混合,只要物质的量一定,则完全燃烧时消耗氧气为一定值,设有机物为CxHyOz,则x+
-
相同,
A.4+
≠3+
,故A不选;
B.5+
=6+
,故B选;
C.2+
-
≠2+
-
,故C不选;
D.3+
≠3+
,故D不选;
故选B.
| y |
| 4 |
| z |
| 2 |
A.4+
| 6 |
| 4 |
| 8 |
| 4 |
B.5+
| 10 |
| 4 |
| 6 |
| 4 |
C.2+
| 6 |
| 4 |
| 1 |
| 2 |
| 4 |
| 4 |
| 2 |
| 2 |
D.3+
| 6 |
| 4 |
| 8 |
| 4 |
故选B.
点评:本题考查化学反应方程式的计算,为高频考点,把握等物质的量消耗氧气为定值为解答的关键,侧重分析能力及计算能力的考查,注意CxHyOz消耗氧气x+
-
相同,题目难度不大.
| y |
| 4 |
| z |
| 2 |

练习册系列答案
相关题目
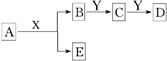 中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )| A、若A是CaC2,X是H2O,则Y一定是溴水 |
| B、若A是金属钠,X是H2O,则E一定能还原Fe2O3 |
| C、若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应 |
| D、若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应 |
下列反应的现象描述与离子方程式都正确的是( )
| A、金属镁与稀盐酸反应:有气泡逸出:Mg+2H++2Cl-═MgCl2+H2↑ |
| B、氯化钡溶液与稀硫酸反应:有白色沉淀生成:Ba2++SO42-═BaSO4↓ |
| C、碳酸钠与盐酸反应:有气泡逸出:Na2CO3+2H+═CO2↑+H2O+2Na+ |
| D、硫酸铜溶液中加入过量的NaOH溶液:有白色沉淀产生:Cu2++2OH-═Cu(OH)2↓ |
短周期元素W、X、Y、Z的原子序数依次增大,且原子最外层电子数之和为14.W的原子半径比X的大,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最高的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
| A、元素X的最高价氧化物对应的水化物的酸性比Z的弱 |
| B、元素Y、Z的简单离子的电子层结构相同 |
| C、元素W与Z形成的化合物为共价化合物 |
| D、原子半径由大到小的顺序为:r(Z)>r(Y)>r (W) |
“阿波罗号飞船”所用的氢氧燃料电池的电极反应为:
负极:2H2+4OH--4e-=4H2O
正极 O2+2H2O+4e-=4OH-
该电池工作时,下列叙述正确的是( )
负极:2H2+4OH--4e-=4H2O
正极 O2+2H2O+4e-=4OH-
该电池工作时,下列叙述正确的是( )
| A、氢气发生还原反应 |
| B、每转移4摩电子,电池内增加4mol水 |
| C、负极附近溶液的PH值降低 |
| D、正极附近C(H+)增大 |
下列关于盐类水解的叙述中,错误的是( )
| A、盐类水解是中和反应的逆反应 |
| B、盐类水解过程是吸热过程 |
| C、含有弱酸根盐的水溶液一定显碱性 |
| D、盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 |
室温下,0.1mol?L-1 CH3COONa溶液与0.1mol?L-1 NaCl溶液等体积混合(忽略溶液体积变化),下列有关叙述正确的是( )
| A、混合前CH3COONa溶液中由水电离出来的c(OH-)>1×10-7mol?L-1 |
| B、混合前NaCl溶液中:c(Na+)+c(OH-)=c(Cl-)+c(H+) |
| C、混合溶液中:c(Cl-)>c(CH3COOH)>c(OH-) |
| D、混合溶液中:c(Cl-)+c(CH3COO-)=0.1mol?L-1 |