题目内容
下列关于粒子半径的说法正确的是( )
| A、电子层数少的元素,其原子半径一定小于电子层数多的元素原子的半径 |
| B、核外电子层结构相同的单核粒子的半径相同 |
| C、质子数相同的不同单核粒子,电子数越多半径越大 |
| D、原子序数越大,原子半径越大 |
考点:微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:A、原子半径由电子层数和核电荷数两个因素决定;
B、核外电子层结构相同的单核粒子的半径取决于核内质子数的多少;
C、质子数相同的不同单核粒子,电子数决定半径大小;
D、原子半径由电子层数和核电荷数两个因素决定.
B、核外电子层结构相同的单核粒子的半径取决于核内质子数的多少;
C、质子数相同的不同单核粒子,电子数决定半径大小;
D、原子半径由电子层数和核电荷数两个因素决定.
解答:
解:A、原子半径由电子层数和核电荷数两个因素决定,电子层数少的元素原子半径不一定小于电子层数多的元素的原子半径,故A错误;
B、核外电子层结构相同的单核粒子,核内质子数越多,半径越小,反之,越大,故B错误;
C、质子数相同的不同单核粒子,电子数越多,则半径越大,故C正确;
D、电子层数相同时,原子序数越大,原子半径越小,电子层数不同时,原子序数越大半径越大,故D错误.
故选C.
B、核外电子层结构相同的单核粒子,核内质子数越多,半径越小,反之,越大,故B错误;
C、质子数相同的不同单核粒子,电子数越多,则半径越大,故C正确;
D、电子层数相同时,原子序数越大,原子半径越小,电子层数不同时,原子序数越大半径越大,故D错误.
故选C.
点评:本题考查学生微粒半径大小的比较方法知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
某有机化合物的结构简式如图所示.用等物质的量的该有机物分别与足量Na、NaOH、NaHCO3反应时,消耗Na、NaOH、NaHCO3的物质的量之比为( )


| A、3:3:3 |
| B、3:2:1 |
| C、1:1:1 |
| D、3:2:2 |
将相同钠块分别投入下列溶液中,反应的剧烈程度最弱的是( )
| A、水 |
| B、乙醇 |
| C、0.1 mol?L-1的盐酸 |
| D、0.1 mol?L-1的NH4Cl溶液 |
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
| A、x+2 | B、x+4 |
| C、x+34 | D、x+26 |
某气体物质质量为6.4g,含有6.02×1022个分子,则该气体的相对分子质量为( )
| A、64 | B、32 | C、96 | D、32 |
绿柱石又称绿宝石,其组成可表示为A3B2(SiO4)3,式中A、B均为金属元素,则A、B对应的化合价依次为( )
| A、+2,+3 |
| B、+3,+2 |
| C、+2,+2 |
| D、+3,+3 |
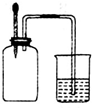 如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )