题目内容
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
| A、x+2 | B、x+4 |
| C、x+34 | D、x+26 |
考点:原子序数
专题:
分析:由元素周期表结构,对于处于ⅠA、ⅡA元素而言,不同周期相邻主族的元素的原子序数差值不同,对于处于其他主族元素而言,不同周期相邻主族的元素的原子序数差值也不同.
解答:
解:由元素周期表结构,对于处于ⅠA、ⅡA元素而言,同主族原子序数之差为上一周期元素的种类数;对于其他主族,同主族原子序数之差为下一周期元素的种类数,同一主族不同周期的元素,原子序数相差可能为2、8、18、32等或它们的组合,如10、26、34等,不可能相差4,即乙原子序数不可能为x+4,
故选B.
故选B.
点评:本题考查学生元素周期表的结构知识,可以根据所学内容来回答,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
把过量SO2气体通入下列溶液中,溶液始终保持澄清的是 ( )
| A、水玻璃 |
| B、澄清石灰水 |
| C、CaCl2溶液 |
| D、Ca(ClO)2溶液 |
已知短周期元素的离子aA2+、bB+、cC2-、dD-具有相同的电子层结构.则下列叙述正确的是( )
| A、原子半径 A>B>C>D |
| B、离子半径 C2->D->B+>A2+ |
| C、原子序数 a<b<d<c |
| D、原子的失电子能力 A>B>D>C |
下列关于粒子半径的说法正确的是( )
| A、电子层数少的元素,其原子半径一定小于电子层数多的元素原子的半径 |
| B、核外电子层结构相同的单核粒子的半径相同 |
| C、质子数相同的不同单核粒子,电子数越多半径越大 |
| D、原子序数越大,原子半径越大 |
下列各组离子在相应的条件下一定能大量共存的是( )
| A、在碱性溶液中:HCO3-、K+、C1-、Na+ |
| B、在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Br-、C1-、K+ |
| C、与铝粉反应放出氢气的无色溶液中:NO3-、K+、Na+、SO42- |
| D、通有SO2的溶液中:Ca2+、C1-、NO3-、A13+ |
设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、等物质的量的N2O和CO2所含分子数均为NA |
| B、0.1 mol OH-中含有的电子数为0.9NA |
| C、1 mol Na2O2固体中所含阴离子数为NA |
| D、标准状况下,2.24 L H2O所含分子数为0.1NA |


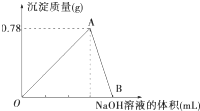 向20mL某浓度的AlCl3溶液中滴加2mol?L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某浓度的AlCl3溶液中滴加2mol?L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题: