题目内容
在0.1mol/L NH4Cl溶液中,离子浓度最大的是 .
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,再结合电荷守恒判断离子浓度大小,据此分析解答.
解答:
解:氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒 c(H+)+c(NH4+)=c(OH-)+c(Cl-),则c(NH4+)<c(Cl-),铵根离子水解较微弱,所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),则离子浓度最大的是Cl-,
故答案为:Cl-.
故答案为:Cl-.
点评:本题考查了离子浓度大小比较,根据盐类水解特点结合电荷守恒判断离子浓度大小,注意盐类水解较微弱,题目难度不大.

练习册系列答案
相关题目
在一定温度和压强下,将一个容积为15mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升至一定高度不再变化时,相同条件下再通入O2,若要使试管内液面仍保持在原高度,则应通入O2体积为( )
| A、3.75 mL |
| B、7.5 mL |
| C、8.75 mL |
| D、10.5 mL |
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明反应A(s)+2B(g)?C(g)+D(g) 已达到平衡状态的是( )
①混合气体的压强,②混合气体的密度,③B的物质的量浓度,④气体的总物质的量,⑤混合气体的平均相对分子质量,⑥V正(B)=2V逆.
①混合气体的压强,②混合气体的密度,③B的物质的量浓度,④气体的总物质的量,⑤混合气体的平均相对分子质量,⑥V正(B)=2V逆.
| A、①②③ | B、②③④⑥ |
| C、②③⑤⑥ | D、①③④⑤ |
已知某元素的阴离子Rn-,其原子核内的中子数为A-x+n,其中A为质量数.则W g Rn-中的电子总数为(NA为阿伏加德罗常数)( )
A、
| ||
B、
| ||
C、
| ||
D、
|
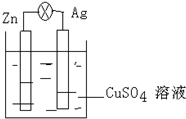 在银锌原电池中,以硫酸铜为电解质溶液.
在银锌原电池中,以硫酸铜为电解质溶液.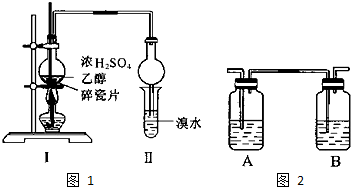 1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷. 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G