题目内容
碱性条件下NaClO溶液和FeSO4反应生成Fe(OH)3 的离子方程式为 .
考点:离子方程式的书写
专题:离子反应专题
分析:次氯酸钠具有强的氧化性,二价铁离子具有强的还原性,在碱性条件下发生氧化还原反应生成氢氧化铁、氯化钠、硫酸铁.
解答:
解:在碱性条件下发生氧化还原反应生成氢氧化铁和硫酸钠,离子方程式为:3H2O+3ClO-+6Fe2+=2Fe(OH)3↓+4Fe3++3Cl-;
故答案为:3H2O+3ClO-+6Fe2+=2Fe(OH)3↓+4Fe3++3Cl-.
故答案为:3H2O+3ClO-+6Fe2+=2Fe(OH)3↓+4Fe3++3Cl-.
点评:本题考查了离子方程式的书写,明确发生反应的实质是解题关键,注意得失电子、原子个数守恒.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
向下列物质的溶液中通入CO2,不发生反应的是( )
| A、Na2CO3 |
| B、NaHCO3 |
| C、Na2SiO3 |
| D、Ca(OH)2 |
下列各组物质在溶液中反应时,离子方程式相同的是( )
| A、BaCl2与Na2SO4、Ba(OH)2与H2SO4 |
| B、KI与Cl2、KBr与Cl2 |
| C、Ag2CO3与盐酸,AgNO3与盐酸 |
| D、NaHCO3与稀硫酸,KHCO3与稀盐酸 |
关于分液操作叙述正确的是 ( )
| A、水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇 |
| B、振摇几次后需打开分液漏斗上口的玻璃塞放气 |
| C、经几次振摇并放气后,手持分液漏斗静置待液体分层 |
| D、放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔 |
把一定量某碱金属与2.7g铝的混合物放入足量水中,金属全部溶解,收集到标准状况下气体5.6L,向所得溶液中通入过量二氧化碳,过滤,把滤液减压蒸发,得固体20g,此碱金属相对原子质量为( )
| A、7 | B、23 | C、39 | D、85 |
下列实验设计和结论相符的是( )
| A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B、某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |
| C、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| D、向乙醇和乙酸的混合溶液中加入饱和Na2CO3 溶液,然后分液,分离出乙醇 |
1mol 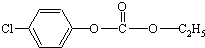 与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是( )
与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是( )
 与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是( )
与足量的NaOH溶液混合共热,充分反应后,最多可消耗NaOH的物质的量是( )| A、3mol | B、4mol |
| C、5mol | D、6mol |
下列系统命名法正确的是( )
| A、2-甲基-4-乙基戊烷 |
| B、3,4,4-三甲基己烷 |
| C、2,3-二乙基-1-戊烯 |
| D、间二甲苯 |