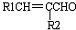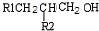题目内容
下列说法正确的是( )
| A、25℃时,任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积都为1×10-14mol2?L-2 |
| B、氯气溶于水达到平衡后,若其他条件不变,加入少量水,水的电离平衡向逆向移动 |
| C、电解法精炼铜,当阴极质量增加32 g时,有6.02×1023个电子转移 |
| D、含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
考点:浓硫酸的性质,水的电离,电解原理
专题:
分析:A.酸或碱抑制水电离,含有弱离子的盐促进水电离;
B.氯气溶于水达到平衡后,若其他条件不变,加入少量水,溶液中氢离子浓度减小,水的电离程度增大;
C.电解精炼粗铜时,阴极上质量增加32g时,析出n(Cu)=
=0.5mol,每个铜离子得到两个电子,据此计算转移电子总数;
D.加热条件下浓硫酸和铜发生氧化还原反应,但稀硫酸和铜不反应,所以生成二氧化硫的物质的量小于硫酸的一半.
B.氯气溶于水达到平衡后,若其他条件不变,加入少量水,溶液中氢离子浓度减小,水的电离程度增大;
C.电解精炼粗铜时,阴极上质量增加32g时,析出n(Cu)=
| 32g |
| 64g/mol |
D.加热条件下浓硫酸和铜发生氧化还原反应,但稀硫酸和铜不反应,所以生成二氧化硫的物质的量小于硫酸的一半.
解答:
解:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以25℃时,任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积可能大于、等于或小于1×10-14mol2?L-2,故A错误;
B.氯气溶于水达到平衡后,若其他条件不变,加入少量水,溶液中氢离子浓度减小,则抑制水电离程度减小,所以水的电离程度增大,水的电离平衡向右移动,故B错误;
C.电解精炼粗铜时,阴极上质量增加32g时,析出n(Cu)=
=0.5mol,每个铜离子得到两个电子,则转移电子总数=0.5mol×2×6.02×1023/mol=6.02×1023,故C正确;
D.加热条件下浓硫酸和铜发生氧化还原反应,但稀硫酸和铜不反应,所以生成二氧化硫的物质的量小于硫酸的一半,则生成SO2的分子数小于6.02×1022,故D错误;
故选C.
B.氯气溶于水达到平衡后,若其他条件不变,加入少量水,溶液中氢离子浓度减小,则抑制水电离程度减小,所以水的电离程度增大,水的电离平衡向右移动,故B错误;
C.电解精炼粗铜时,阴极上质量增加32g时,析出n(Cu)=
| 32g |
| 64g/mol |
D.加热条件下浓硫酸和铜发生氧化还原反应,但稀硫酸和铜不反应,所以生成二氧化硫的物质的量小于硫酸的一半,则生成SO2的分子数小于6.02×1022,故D错误;
故选C.
点评:本题考查水的电离、氧化还原反应的计算、电解精炼等知识点,明确水电离的影响因素、反应方程式中各个物理量的关系是解本题关键,注意浓硫酸、稀硫酸性质的区别,题目难度不大.

练习册系列答案
相关题目
下列溶液中,微粒浓度关系正确的是( )
| A、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) |
| C、0.1 mol/L 的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
将CO2通入下列物质的溶液中,不与其反应的是( )
①Na2CO3②Na2SiO3③Na[Al(OH)4]④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3?
①Na2CO3②Na2SiO3③Na[Al(OH)4]④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3?
| A、①③④⑤⑥ | B、①和⑥ |
| C、只有① | D、只有⑥ |
下面关于硅的叙述中,正确的是( )
| A、硅的化学性质不活泼,常温下不与任何物质反应 |
| B、硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 |
| C、硅的化学性质不活泼,在自然界中可以以游离态存在 |
| D、硅在电子工业中,是重要的半导体材料 |
下列各原子或离子的电子排布式错误的是( )
| A、K+ 1s22s22p63s23p6 |
| B、As 1s22s22p63s23p64s24p3 |
| C、N3- 1s22s22p6 |
| D、Cr 1s22s22p63s23p63d44s2 |
下列说法正确的是( )
①金属钠、氢气都能在氯气中燃烧,生成白色烟雾;
②铜丝在氯气中燃烧,生辰蓝绿色的氯化铜;
③点燃是使氯气跟氢气化合的唯一条件;
④氯气跟变价金属反应生成高价金属氯化物.
①金属钠、氢气都能在氯气中燃烧,生成白色烟雾;
②铜丝在氯气中燃烧,生辰蓝绿色的氯化铜;
③点燃是使氯气跟氢气化合的唯一条件;
④氯气跟变价金属反应生成高价金属氯化物.
| A、②③ | B、①② | C、①④ | D、④ |
我国镍氢电池居世界先进水平.常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+6NiO(OH)?LaNi5+6Ni(OH)2,下列说法正确的是( )
| A、放电时储氢合金作正极 |
| B、充电时阳极周围c(OH-)增大 |
| C、放电时负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O |
| D、充电时储氢合金作阳极 |
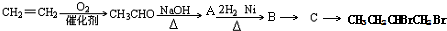
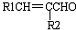 +H2O(-R1、R2表示氢原子或烃基)
+H2O(-R1、R2表示氢原子或烃基)