题目内容
18.草酸晶体的组成可表示为H2C2O4•xH2O,为测定x值,进行下列实验.①称取m g草酸晶体,配成100.0mL溶液.
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol•L-1 KMnO4溶液滴定.滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和100mL容量瓶、胶头滴管、玻璃棒.
(2)在实验②中,滴定时KMnO4溶液应装在酸式滴定管中,锥形瓶中不需要(填“需要”或“不需要”)滴加指示剂.
(3)在滴定过程中,目光应注视锥形瓶中溶液颜色的变化.
(4)若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出草酸晶体x值为$\frac{50m}{9c×(b-a)}-5$.
(5)若读取读数a时仰视,读取读数b时俯视,则所测x值偏大(填“偏大”、“偏 小”或“不变”).
分析 (1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
(2)酸性滴定管用玻璃活塞,碱性滴定管具有橡皮管,KMnO4溶液具有强氧化性,可以腐蚀橡皮管,KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂;
(3)在滴定过程中,目光应注视锥形瓶中溶液颜色的变化;
(4)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,根据关系式2KMnO4~5H2C2O4计算25.0mL草酸溶液中n(H2C2O4),进而计算100mL草酸溶液中n′(H2C2O4),计算草酸的质量,根据化学式质量分数的计算求X的值;
(5)读取读数a时仰视,a偏大,读取读数b时俯视,b偏小,导致KMnO4溶液体积偏小,计算测定的草酸的质量偏小.
解答 解:(1)实验①中为了配制准确浓度的草酸溶液100.0mL,所需要的实验仪器主要有天平(含砝码)用来称量草酸固体的质量、烧杯溶解固体、药匙取固体药品、100mL容量瓶、胶头滴管、玻璃棒等,故还需要100mL容量瓶、胶头滴管、玻璃棒,
故答案为:100mL容量瓶;胶头滴管;玻璃棒;
(2)KMnO4溶液具有强氧化性,可以腐蚀碱性滴定管的橡皮管,故KMnO4溶液应装在酸式滴定管中;KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂,
故答案为:酸;不需要;
(3)在滴定过程中,目光应注视锥形瓶中溶液颜色的变化,
故答案为:锥形瓶中溶液颜色的变化;
(4)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,n(KMnO4)=c mol•L-1×(b-a)×10-3L=c×(b-a)×10-3mol,根据2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O可得关系式2KMnO4~5H2C2O4可知25.0mL草酸溶液中n(H2C2O4)=2.5×c×(b-a)×10-2mol,进而计算100mL草酸溶液中n′(H2C2O4)=2.5×c×(b-a)×10-2mol×$\frac{100mL}{25mL}$=c×(b-a)×10-2mol,草酸晶体中草酸的质量为c×(b-a)×10-2mol×90g/mol=0.9c(b-a)g,由化学式H2C2O4•xH2O可知:$\frac{90}{90+18x}$=$\frac{0.9c(b-a)g}{mg}$,解得x=$\frac{50m}{9c×(b-a)}-5$,
故答案为:$\frac{50m}{9c×(b-a)}-5$;
(5)读取读数a时仰视,a偏大,读取读数b时俯视,b偏小,故导致KMnO4溶液体积偏小,计算测定的草酸的质量偏小,故x的值偏大,
故答案为:偏大.
点评 本题考查一定物质的量浓度溶液配制、滴定操作、滴定应用与计算、物质组成含量测定等,难度中等,注意滴定中经常根据关系式进行计算,掌握根据关系式计算方法.

(1)SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
(2)Si+2Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$SiCl4
(3)SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
| A. | (1)(3)为置换反应 | B. | (2)为化合反应 | ||
| C. | 只有(1)(3)为氧化还原反应 | D. | (1)(2)(3)均为氧化还原反应 |
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3CH(NH2)CH2COOH 3-氨基丁酸 | ||
| C. | 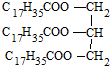 硬脂酸甘油脂 硬脂酸甘油脂 | D. | 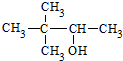 2,2-二甲基-3-丁醇 2,2-二甲基-3-丁醇 |
 ,该化合物中化学键类型有离子键、共价键.
,该化合物中化学键类型有离子键、共价键. .
. 甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系:甲+H2O→丙+丁
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系:甲+H2O→丙+丁 H++AlO2-+H2O.
H++AlO2-+H2O. .
. A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.