题目内容
用50mL 0.1mol/L的 NaCl溶液配制300mL 0.5mol/L的NaCl溶液,约需加水 mL,加NaCl固体 g.
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:原氯化钠溶液体积加水的体积约是300mL,据此计算约需加水体积;根据n=cV计算50mL 0.1mol/L的 NaCl溶液、300mL 0.5mol/L的NaCl溶液中NaCl的物质的量,进而计算需要加入NaCl的物质的量,再根据m=nM计算加入NaCl的质量.
解答:
解:用50mL 0.1mol/L的 NaCl溶液配制300mL 0.5mol/L的NaCl溶液,约需加水体积=300mL-50mL=250mL;
50mL 0.1mol/L的 NaCl溶液中NaCl的物质的量=0.05L×0.1mol/L=0.005mol,300mL 0.5mol/L的NaCl溶液中NaCl的物质的量=0.3L×0.5mol/L=0.015mol,则需要加入NaCl的质量=(0.015mol-0.005mol)×58.5g/mol=0.585g,
故答案为:250;0.585.
50mL 0.1mol/L的 NaCl溶液中NaCl的物质的量=0.05L×0.1mol/L=0.005mol,300mL 0.5mol/L的NaCl溶液中NaCl的物质的量=0.3L×0.5mol/L=0.015mol,则需要加入NaCl的质量=(0.015mol-0.005mol)×58.5g/mol=0.585g,
故答案为:250;0.585.
点评:本题考查物质的量有关计算,难度不大,侧重对基础知识的巩固.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对于反应:A(g)+qB(g)=pC(g),经t秒后C的浓度增加了m mol/L,则用B浓度的变化表示的反应速率大小为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列物质中属于碱性氧化物的是( )
| A、O2 |
| B、Na2O |
| C、NaClO |
| D、SO2 |
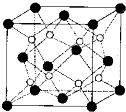 (1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题: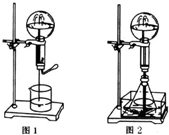 喷泉是一种常见的自然现象,其产生原因是存在压强差.
喷泉是一种常见的自然现象,其产生原因是存在压强差.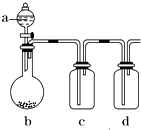 有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.
有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.