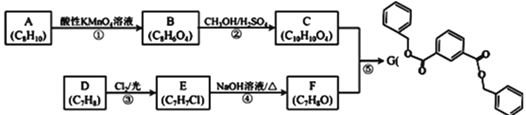
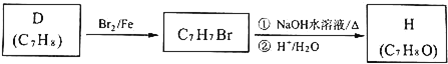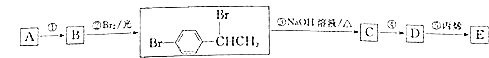题目内容
【题目】工业合成氨反应为N2(g)+3H2(g) ![]() 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,N≡N键的键能是945.6 kJ·mol-1,则上述反应的ΔH=_________________________。
(2)上述反应的平衡常数K的表达式为_______________________________。
若反应方程式改写为![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g),在该温度下的平衡常数K1=_________(用K表示)。
NH3(g),在该温度下的平衡常数K1=_________(用K表示)。
(3)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填“大于”、“小于”或“等于”)v逆。
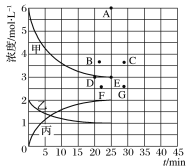
②由上表中的实验数据计算得到“浓度时间”的关系可用下图中的曲线表示,表示c(N2)t的曲线是_____。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)t的曲线上相应的点为________________。
【答案】-92.4 kJ·mol-1 K=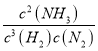
![]() 大于 乙 B
大于 乙 B
【解析】
(1)利用ΔH=反应物的总键能-生成物的总键能进行计算;
(2)平衡常数等于生成物幂之积除以反应物幂之积;
(3)①根据Qc与K的大小关系进行分析判断;
②由①中三段法进行分析比较。
(1)ΔH=反应物的总键能-生成物的总键能=945.6 kJ·mol-1+3×436 kJ·mol-1-2×3×391 kJ·mol-1=-92.4 kJ·mol-1;
(2)平衡常数K=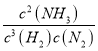 ;平衡常数K1=
;平衡常数K1=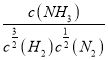 =
=![]()
(3)①根据表格中的数据可知,25min时反应达到了平衡状态,根据三段法有:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
始(mol/L) 2 6 0
转(mol/L) 1 3 2
平(mol/L) 1 3 2
该温度下的平衡常数K=![]() =
=![]() 。该温度下,向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,Qc=
。该温度下,向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,Qc=![]() =
=![]() <K,则反应正向移动,那么v正>v逆;
<K,则反应正向移动,那么v正>v逆;
②N2为反应物,随着反应的进行,浓度逐渐降低,根据①中三段法可知,达到平和时,N2的浓度为1mol/L,那么,表示c(N2)t的曲线是乙;
若起始充入4 mol N2和12 mol H2,若平衡不移动,H2的浓度为6mol/L,现相当于增大了压强,且压强增大到原来的2倍,平衡正向移动,H2的浓度减小,但依然大于3mol/L,则3mol/L<c(H2)<6mol/L;浓度越大,化学反应速率越快,达到平衡的时间越短,则表示c(H2)t的曲线上相应的点为B点。
Q<K | 反应向正反应方向进行,v正>v逆 |
Q=K | 反应处于化学平衡状态,v正=v逆 |
Q>K | 反应向逆反应方向进行,v正<v逆 |

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
【题目】I. 用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
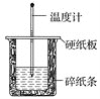
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。
(3)实验时所用盐酸及NaOH溶液的体积均为50 mL,各溶液密度均为1 g·mL-1,生成溶液的比热容c=4.18 J·g-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式ΔH=________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
II.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | VmL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(2)若t1<8,则由此实验可以得出的结论是________________________________