题目内容
(1)A、B、C三种气体在体积为2L的密闭容器中发生反应,在不同反应时间各物质的量的变化情况如图所示.
①该反应的化学方程式为 .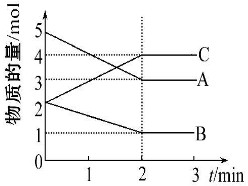
②从0~2min用C表示此反应的速率为 .
③此反应达到最大限度时A的转化率是
(2)某学生为了探究锌与盐酸反应过程中速率变化,在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
①在0min~1min、1min~2min、2min~3min、3min~4min、4min~5min时间段中,反应速率最大的时间段是 ,原因为 ;
②在2min~3min时间段内,用盐酸的浓度变化表示的反应速率为 .
③为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是 .
A.蒸馏水 B.NaNO3溶液 C.Na2SO4溶液 D.CuSO4溶液.
①该反应的化学方程式为

②从0~2min用C表示此反应的速率为
③此反应达到最大限度时A的转化率是
(2)某学生为了探究锌与盐酸反应过程中速率变化,在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
②在2min~3min时间段内,用盐酸的浓度变化表示的反应速率为
③为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是
A.蒸馏水 B.NaNO3溶液 C.Na2SO4溶液 D.CuSO4溶液.
考点:化学平衡的计算,反应速率的定量表示方法,化学反应速率的影响因素
专题:化学平衡专题,化学反应速率专题
分析:(1)①根据物质的量的变化之比等于化学计量数之比书写方程式;
②根据v=
计算反应速率;
③根据A的变化量与A的起始量之比求得转化率;
(2)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,生成气体体积越大的时间段,反应速率越大,结合温度、浓度对反应速率的影响分析;
②计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=
计算反应速率;
③为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量.
②根据v=
| △c |
| △t |
③根据A的变化量与A的起始量之比求得转化率;
(2)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,生成气体体积越大的时间段,反应速率越大,结合温度、浓度对反应速率的影响分析;
②计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=
| △c |
| △t |
③为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量.
解答:
解:(1)①由图象可以看出,反应中A、B的物质的量减小,C的物质的量增多,则A、B为反应物,C为生成物,由于在同一容器中,浓度之比等于物质的量之比,故有△n(A):△n(B):△n(C)=2mol:1mol:2mol=2:1:2,则反应的化学方程式为:2A+B  2C,
2C,
故答案为:2A+B 2C;
2C;
②反应开始至2分钟时,用C表示反应速率为
=0.5mol/(L?min),故答案为:0.5mol/(L?min);
③平衡时A的转化率
×100%=40%,
故答案为:40%;
(2)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,由此可知反应速率最大的时间段为2~3 min,因反应为放热反应,温度升高,反应速率增大,
故答案为:2~3 min;因该反应是放热反应;
②在2~3min时间段内,n(H2)=
=0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,
则υ(HCl)=
=0.1 mol/(L?min),
故答案为:υ(HCl)=0.1 mol/(L?min);
③A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;
B.加入NaNO3溶液,生成NO气体,影响生成氢气的量,故B错误;
C. 加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故C正确;
D.加入CuSO4溶液,Zn置换出Cu反应速度增大,但影响生成氢气的量,故D错误;
故答案为:A、C.
 2C,
2C,故答案为:2A+B
 2C;
2C;②反应开始至2分钟时,用C表示反应速率为
| ||
| 2min |
③平衡时A的转化率
| 5mol-3mol |
| 5mol |
故答案为:40%;
(2)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,由此可知反应速率最大的时间段为2~3 min,因反应为放热反应,温度升高,反应速率增大,
故答案为:2~3 min;因该反应是放热反应;
②在2~3min时间段内,n(H2)=
| 0.112L |
| 22.4L/mol |
则υ(HCl)=
| ||
| 1min |
故答案为:υ(HCl)=0.1 mol/(L?min);
③A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;
B.加入NaNO3溶液,生成NO气体,影响生成氢气的量,故B错误;
C. 加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故C正确;
D.加入CuSO4溶液,Zn置换出Cu反应速度增大,但影响生成氢气的量,故D错误;
故答案为:A、C.
点评:本题考查了化学方程式的书写、反应速率、转化率的计算,题目难度不大,本题注意根据把握影响反应速率的因素.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
葡萄糖是一种单糖的主要原因是( )
| A、结构简单 |
| B、不能水解的最简单的糖 |
| C、分子中含羟基和醛基的个数少 |
| D、分子中含碳原子个数少 |
某有机物结构简式如图所示,下列有关该有机物叙述正确的是( )


| A、该有机物分子式为C9H8O3 |
| B、该有机物可以和氯化铁溶液发生显色反应 |
| C、1mol该有机物与溴水反应,最多消耗2mol Br2 |
| D、1mol该有机物最多与2mol NaOH反应 |
丁烷的二氯取代产物为A(C4H8Cl2),A分子又有一个H原子被Br取代,生成C4H7Cl2Br有四种同分异构体,则A的结构有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
化学与生活密切相关,下列说法错误的是( )
| A、水是人类不可缺少的营养物质 |
| B、工业废水“再生”处理后可用于城市道路的保洁 |
| C、地沟油的主要成分是高级脂肪酸酯 |
| D、天宫一号中使用的碳纤维是一种新型有机高分子材料 |
