题目内容
7.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )| A. | 苏打-NaHCO3 | B. | 胆矾-CuSO4 | C. | 酒精-C2H5OH | D. | 生石灰-Ca(OH)2 |
分析 A.苏打为碳酸钠,碳酸氢钠的俗名为小苏打;
B.胆矾中含有5个结晶水;
C.酒精为乙醇的俗名,为含有2个碳原子的饱和一元醇;
D.石灰石为氧化钙的俗名,氢氧化钙的俗名为熟石灰.
解答 解:A.NaHCO3的俗名为小苏打,苏打为碳酸钠,化学式为:Na2CO3,故A错误;
B.胆矾为无水硫酸铜,正确的化学式为:CuSO4•5H2O,故B错误;
C.酒精为乙醇的俗名,其分子式为:C2H5OH,故C正确;
D.Ca(OH)2为氢氧化钙,俗名为熟石灰,生石灰为氧化钙,化学式为CaO,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,明确常见物质组成、化学式与俗名的关系为解答关键,试题有利于提高学生的分析能力及规范答题能力.

练习册系列答案
相关题目
17.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如图:
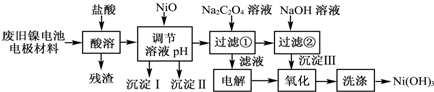
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O;
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)慢慢加入NiO以调节溶液的pH至4.2至7.6(填写范围),
依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3 (填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)加入Na2C2O4时最好采用饱和的Na2C2O4溶液,理由是尽可能的将溶液中的Ni2+沉淀完全.
(4)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸,试纸变蓝色.
(5)实验中,沉淀Ⅲ的氧化是在碱性条件下发生的.写出该“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O;
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)慢慢加入NiO以调节溶液的pH至4.2至7.6(填写范围),
依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3 (填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)加入Na2C2O4时最好采用饱和的Na2C2O4溶液,理由是尽可能的将溶液中的Ni2+沉淀完全.
(4)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸,试纸变蓝色.
(5)实验中,沉淀Ⅲ的氧化是在碱性条件下发生的.写出该“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
18.O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
| A. | 氧气是氧化产物 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48LHF,则转移0.8mol电子 | |
| D. | 还原剂与氧化剂的物质的量之比为1:4 |
15.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18.下列说法正确的是( )
| A. | 原子半径由大到小:Z>Y>X>W | B. | 阴离子的还原性:Y>Z | ||
| C. | 氢化物的沸点:Y>X | D. | 氧化物对应水化物的酸性:Y<Z |
12.下列说法中,正确的是( )
| A. | SO2的摩尔质量是64g | |
| B. | 标准状况下18g水的体积是22.4L | |
| C. | 在标准状况下,20 mLNH3 与60 mLO2所含的分子数比为1:3 | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
19.下列反应的离子方程式书写正确的是( )
| A. | 过氧化钠和水反应 Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | Ca(ClO)2溶液中通入少量二氧化碳:ClO-+H2O+CO2=HClO+CO32- | |
| D. | 向氯化铝溶液中滴入足量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
16.2015年5月郴州成功举办了第三届中国(湖南)国际矿物宝石博览会.矿博会上展示了色彩缤纷、形状各异的金属矿物,下列金属的冶炼属于热还原法的是( )
| A. | 2NaCl(熔融)=2Na+Cl2↑ | B. | WO3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$W+3H2O | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |