题目内容
短周期元素R、T、Q、X、Y的原子序数依次递增,R原子的最外层电子数是其内层电子数的一半.T和X原子最外层电子数之比为1:1,原子序数比为1:2,Q的氢氧化物既能溶于强酸又能溶于强碱.
(1)R的原子结构示意图为 ;
(2)T、X的最低价氢化物中,稳定的是 ;
(3)X2Y2广泛用于橡胶工业,分子中各原子最外层均达到8电子稳定结构,则X2Y2的结构式为 ;
(4)R-Q/FeS是一种可充电电池,电池中用含R+单点固体作为电解质,该电池的电池反应式为:2R+FeS=R2S+Fe,则该电池的正极的电极反应式为
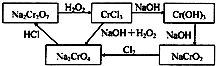
(5)现有Cr3-和Q3+的混合溶液(已知Cr的化合物存在如图转化),欲使这两种离子相互分离,依次加入的试剂是① 、②Cl2、③CO2、④HCl和 .写出向溶液中通入足量CO2时反应的离子方程式 .
(1)R的原子结构示意图为
(2)T、X的最低价氢化物中,稳定的是
(3)X2Y2广泛用于橡胶工业,分子中各原子最外层均达到8电子稳定结构,则X2Y2的结构式为
(4)R-Q/FeS是一种可充电电池,电池中用含R+单点固体作为电解质,该电池的电池反应式为:2R+FeS=R2S+Fe,则该电池的正极的电极反应式为
(5)现有Cr3-和Q3+的混合溶液(已知Cr的化合物存在如图转化),欲使这两种离子相互分离,依次加入的试剂是①

考点:位置结构性质的相互关系应用
专题:
分析:短周期元素R、T、Q、X、Y的原子序数依次递增,Q的氢氧化物既能溶于强酸又能溶于强碱,则Q为铝元素,T和X原子最外层电子数之比为1:1,即位于同主族,原子序数比为1:2,且它们的原子序数一个比铝小,一个比铝大,所以T为氧元素,X为硫元素,则Y为氯元素,R原子的最外层电子数是其内层电子数的一半则R为锂或磷,原子序数小于氧,则R为锂元素,据此答题.
解答:
解:短周期元素R、T、Q、X、Y的原子序数依次递增,Q的氢氧化物既能溶于强酸又能溶于强碱,则Q为铝元素,T和X原子最外层电子数之比为1:1,即位于同主族,原子序数比为1:2,且它们的原子序数一个比铝小,一个比铝大,所以T为氧元素,X为硫元素,则Y为氯元素,R原子的最外层电子数是其内层电子数的一半则R为锂或磷,原子序数小于氧,则R为锂元素,
(1)R为锂元素,它的原子结构示意图为 ,
,
故答案为: ;
;
(2)同主族元素,从上向下,氢化物稳定性逐渐减弱,所以硫化氢的稳定性小于水,
故答案为:H2O;
(3)X2Y2为S2Cl2,分子中各原子最外层均达到8电子稳定结构,则X2Y2的结构式为Cl-S-S-Cl,
故答案为:Cl-S-S-Cl;
(4)电池中用含Li+单点固体作为电解质,该电池的电池反应式为:2Li+FeS=Li2S+Fe,则该电池的正极是氧化剂FeS被还原成Fe,所以电极反应式为2Li++FeS+2e-=Li2S+Fe,
故答案为:2Li++FeS+2e-=Li2S+Fe;
(5)Cr3+和Al3+的混合溶液,欲使这两种离子相互分离,首先加入的试剂是过量的氢氧化钠,使铝离子生成偏铝酸根,而与氢氧化铬分离,根据图中关系可知,要使Cr3+生成铬酸钠,需要加入双氧水,在③中通CO2,是偏铝酸钠与反应CO2,反应的离子方程式为CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-,
故答案为:NaOH;H2O2;CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-.
(1)R为锂元素,它的原子结构示意图为
 ,
,故答案为:
 ;
;(2)同主族元素,从上向下,氢化物稳定性逐渐减弱,所以硫化氢的稳定性小于水,
故答案为:H2O;
(3)X2Y2为S2Cl2,分子中各原子最外层均达到8电子稳定结构,则X2Y2的结构式为Cl-S-S-Cl,
故答案为:Cl-S-S-Cl;
(4)电池中用含Li+单点固体作为电解质,该电池的电池反应式为:2Li+FeS=Li2S+Fe,则该电池的正极是氧化剂FeS被还原成Fe,所以电极反应式为2Li++FeS+2e-=Li2S+Fe,
故答案为:2Li++FeS+2e-=Li2S+Fe;
(5)Cr3+和Al3+的混合溶液,欲使这两种离子相互分离,首先加入的试剂是过量的氢氧化钠,使铝离子生成偏铝酸根,而与氢氧化铬分离,根据图中关系可知,要使Cr3+生成铬酸钠,需要加入双氧水,在③中通CO2,是偏铝酸钠与反应CO2,反应的离子方程式为CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-,
故答案为:NaOH;H2O2;CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-.
点评:本题主要考查了原子结构示意图、结构式、原电池反应、离子方程式等知识点,中等难度,解题的关键在于元素的推断.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
加入适当的氧化剂才能实现下列变化的是( )
| A、Fe2+→Fe3+ |
| B、S2-→H2S |
| C、MnO4-→Mn2+ |
| D、AlO2-→Al3+ |
下列叙述错误的是( )
| A、酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 |
| B、只含有一种元素的物质不一定都是纯净物 |
| C、电离产生H+的化合物叫酸,其分子中氢原子的个数即是该酸的元数 |
| D、压强恒定时,气体在水中的溶解度随温度的升高而降低 |
如图实验装置,工作过程中乙池CuSO4溶液的浓度没有明显改变,下列有关说法正确的是( )
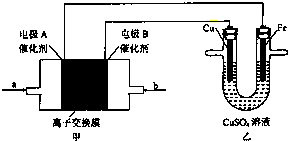

| A、工作是,Cu电极的电极反应为Cu2++2e-=Cu |
| B、工作一段时间后,Cu电极的质量将减小,Fe电极的质量将增加 |
| C、若甲池中a是CH4,b是O2,电解质溶液是KOH,则甲池内溶液的pH将升高 |
| D、若甲池电解质溶液为稀H2SO4,则a为O2,电极A反应为O2+4H++4e-=2H2O |
下列说法正确的是( )
| A、泥沙和水的混合物可用分液漏斗分离 |
| B、测溶液pH值:将一小块pH试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 |
| C、用丁达尔现象可区分氢氧化铁胶体和氯化铁溶液 |
| D、氢氧化钠溶液保存在带有玻璃塞的试剂瓶中 |
生活中的一些问题常涉及化学知识,下列叙述正确的是( )
| A、过多食用糖类物质如淀粉等不会致人发胖 |
| B、纤维素在人体消化过程中起重要作用,纤维素可以作为人类的营养物质 |
| C、淀粉在人体内直接被吸收,供人体组织的营养需要 |
| D、棉花的主要成分是纤维素 |