题目内容
H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面.
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:H2O2+Fe2+═?OH+OH-+Fe3+
H2O2+Fe3++?OH+OH-═Fe2++O2↑+2H2O,则Fe2+在此过程中所起的作用是 ,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为 mol.
(2)如表是在常压、60℃和不同pH条件下,6mL30%在60min H2O2内释放出氧气的体积.则下列说法正确的是 .
a.pH越大,H2O2的分解速率越大
b.pH在9左右,H2O2的分解速率最大
c.6mL 30%分解最多释放出的氧气的体积为639mL
d.pH=5.50时,0~60min内,v=1.5mL?min-1
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-被还原为Mn2+,该反应的离子方程式为 .
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2.电解过程中,阳极区溶液的pH_(填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为 .若不通空气,则阴极得到的产物是 .
(5)己知断裂1mol化学键所需的能量(kJ):H为436、O=O为498、o-o为143,H-O为463.则H2(g)+O2(g)═H2O2(g)的△H= kJ?mol-1.
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:H2O2+Fe2+═?OH+OH-+Fe3+
H2O2+Fe3++?OH+OH-═Fe2++O2↑+2H2O,则Fe2+在此过程中所起的作用是
(2)如表是在常压、60℃和不同pH条件下,6mL30%在60min H2O2内释放出氧气的体积.则下列说法正确的是
| pH | 4.13 | 5.50 | 7.00 | 8.00 | 9.00 | 10.10 | 11.20 | 13.20 |
| V(O2)/mL | 9.0 | 90 | 467 | 595 | 639 | 550 | 500 | 455 |
b.pH在9左右,H2O2的分解速率最大
c.6mL 30%分解最多释放出的氧气的体积为639mL
d.pH=5.50时,0~60min内,v=1.5mL?min-1
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-被还原为Mn2+,该反应的离子方程式为
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2.电解过程中,阳极区溶液的pH_(填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为
(5)己知断裂1mol化学键所需的能量(kJ):H为436、O=O为498、o-o为143,H-O为463.则H2(g)+O2(g)═H2O2(g)的△H=
考点:氧化还原反应的电子转移数目计算,离子方程式的书写,氧化还原反应,反应热和焓变,化学平衡建立的过程,电解原理
专题:基本概念与基本理论
分析:(1)反应的总方程式为2H2O2═2H2O+O2↑,Fe2+起到催化剂的作用;根据方程式结合化合价升降来确定转移电子数;
(2)根据表中的数据确定pH变化和双氧水的分解速率之间的关系;
(3)高锰酸根据有强氧化性,能将双氧水氧化;
(4)电解池的阳极上是阴离子发生失电子的氧化反应,阴极上发生得电子的还原反应,据此回答;
(5)旧键的断裂吸收能量,新键的生成释放能量,两个能量的差值即为反应的能量变化值,当旧键的断裂吸收能量大于新键的生成释放能量,则反应是吸热反应,反之是放热反应.
(2)根据表中的数据确定pH变化和双氧水的分解速率之间的关系;
(3)高锰酸根据有强氧化性,能将双氧水氧化;
(4)电解池的阳极上是阴离子发生失电子的氧化反应,阴极上发生得电子的还原反应,据此回答;
(5)旧键的断裂吸收能量,新键的生成释放能量,两个能量的差值即为反应的能量变化值,当旧键的断裂吸收能量大于新键的生成释放能量,则反应是吸热反应,反之是放热反应.
解答:
解:(1)反应的总方程式为2H2O2═2H2O+O2↑,Fe2+起到催化剂的作用,根据反应:2H2O2═2H2O+O2↑,当生成22400mL O2(标准状况)时,反应中转移电子的物质的量为2mol,所以当生成336mLO2(标准状况)时,反应中转移电子的物质的量为0.03mol,故答案为:催化作用(或催化剂); 0.03;
(2)a.pH越大,H2O2的分解速率显示增大,后减小,故错误;
b.从数据可以知道:pH在9左右,H2O2的分解速率最大,故正确;
c.6mL 30%分解最多释放出的氧气的体积的最大值应该是pH处于9~10之间,故错误;
d.pH=5.50时,0~60min内,v=
=1.5mL?min-1,故正确;
故选:bd;
(3)高锰酸根据有强氧化性,能将双氧水氧化,反应实质是:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O,故答案为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(4)电解池的阳极上是阴离子氢氧根离子发生失电子的氧化反应,氢氧根浓度减小,所以pH会减小,阴极上先是氧气发生得电子的还原反应,即O2+2H++2e-═H2O2,随着空气的不断通入,会在阴极上产生氢气,故答案为:减小;O2+2H++2e-═H2O2;H2;
(5)解:拆开化学键的过程是吸收能量的过程,所以拆开1molH2和1molO2中的化学键吸收的能量为:436kJ/mol+498kJ/mol=934kJ/mol,形成化学键的过程是释放能量的过程,则形成2molH-O键释放的能量为:463kJ/mol×2=926kJ/mol,形成1molO-O键释放的能量为:143kJ/mol,共释放能量为1069kJ/mol,旧键的断裂吸收能量小于新键的生成释放能量,则反应是放热反应,放出的能量为1069kJ/mol-934kJ/mol=135kJ/mol.
故答案为:-135.
(2)a.pH越大,H2O2的分解速率显示增大,后减小,故错误;
b.从数据可以知道:pH在9左右,H2O2的分解速率最大,故正确;
c.6mL 30%分解最多释放出的氧气的体积的最大值应该是pH处于9~10之间,故错误;
d.pH=5.50时,0~60min内,v=
| 90mL |
| 60min |
故选:bd;
(3)高锰酸根据有强氧化性,能将双氧水氧化,反应实质是:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O,故答案为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(4)电解池的阳极上是阴离子氢氧根离子发生失电子的氧化反应,氢氧根浓度减小,所以pH会减小,阴极上先是氧气发生得电子的还原反应,即O2+2H++2e-═H2O2,随着空气的不断通入,会在阴极上产生氢气,故答案为:减小;O2+2H++2e-═H2O2;H2;
(5)解:拆开化学键的过程是吸收能量的过程,所以拆开1molH2和1molO2中的化学键吸收的能量为:436kJ/mol+498kJ/mol=934kJ/mol,形成化学键的过程是释放能量的过程,则形成2molH-O键释放的能量为:463kJ/mol×2=926kJ/mol,形成1molO-O键释放的能量为:143kJ/mol,共释放能量为1069kJ/mol,旧键的断裂吸收能量小于新键的生成释放能量,则反应是放热反应,放出的能量为1069kJ/mol-934kJ/mol=135kJ/mol.
故答案为:-135.
点评:本题考查学生氧化还原反应以及化学反应中的能量变化知识,注意旧键的断裂吸收能量,新键的生成释放能量,二者的大小决定反应的吸放热情况,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关化学用语表示正确的是( )
A、甲烷分子球棍模型: |
| B、二氧化硅的分子式:SiO2 |
C、S2-离子结构示意图 |
D、聚丙烯的结构简式: |
化学与生活、社会密切相关.下列说法中正确的是( )
| A、酿酒过程中,葡萄糖可通过水解反应生成酒精 |
| B、利用催化转化装置可以将汽车尾气中的NO和CO转化为无害气体 |
| C、酸性高锰酸钾溶液中加入植物油充分振荡后,溶液紫色不会褪去 |
| D、制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |

 ),该反应属于
),该反应属于
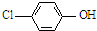 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.