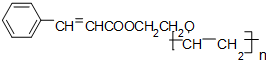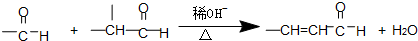题目内容
(1)实验室常用盐酸的质量分数为36.5%,密度为1.20g/cm3.计算此浓盐酸的物质的量浓度.
(2)取100mLNa2CO3和Na2SO4的混合液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出.试计算:原混合物中Na2CO3和Na2SO4的物质的量浓度分别是多少.
(2)取100mLNa2CO3和Na2SO4的混合液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出.试计算:原混合物中Na2CO3和Na2SO4的物质的量浓度分别是多少.
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)根据c=
计算此浓盐酸的物质的量浓度;
(2)沉淀14.51g为BaSO4和BaCO3的混合物,过量稀硝酸处理后沉淀质量减少到4.66g,则m(BaSO4)=4.66g,进而计算m(BaCO3),再根据n=
计算各自物质的量,根据碳酸根、硫酸根守恒计算碳酸钠、硫酸钠的物质的量,根据c=
计算碳酸钠、硫酸钠的物质的量浓度.
| 1000ρw |
| M |
(2)沉淀14.51g为BaSO4和BaCO3的混合物,过量稀硝酸处理后沉淀质量减少到4.66g,则m(BaSO4)=4.66g,进而计算m(BaCO3),再根据n=
| m |
| M |
| n |
| V |
解答:
解:(1)质量分数为36.5%,密度为1.20g/cm3的浓盐酸的物质的量浓度=(1000×1.20×36.5%÷36.5)mol/L=12.0mol/L,
答:该浓盐酸的浓度为12.0mol/L;
(2)沉淀为BaSO4和BaCO3的混合物,过量稀硝酸处理后沉淀质量减少到4.66g,则m(BaSO4)=4.66g,则m(BaSO4)=4.66g,故m(BaCO3)=14.51-4.66=9.85g;
n(Na2SO4)=n(BaSO4)=
=0.02mol,
n(Na2CO3)=n(BaCO3)=
=0.05mol,
所以c(Na2SO4)=
=0.2mol/L,
c(Na2CO3)=
=0.5mol/L,
答:原混合物中Na2CO3的物质的量浓度为0.5mol/L,Na2SO4的物质的量浓度为0.2mol/L.
答:该浓盐酸的浓度为12.0mol/L;
(2)沉淀为BaSO4和BaCO3的混合物,过量稀硝酸处理后沉淀质量减少到4.66g,则m(BaSO4)=4.66g,则m(BaSO4)=4.66g,故m(BaCO3)=14.51-4.66=9.85g;
n(Na2SO4)=n(BaSO4)=
| 4.66g |
| 233g/mol |
n(Na2CO3)=n(BaCO3)=
| 9.85g |
| 197g/mol |
所以c(Na2SO4)=
| 0.02mol |
| 0.1L |
c(Na2CO3)=
| 0.05mol |
| 0.1L |
答:原混合物中Na2CO3的物质的量浓度为0.5mol/L,Na2SO4的物质的量浓度为0.2mol/L.
点评:本题考查物质的量浓度计算,难度中等,注意理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
200mL3mol/LNaOH溶液,现欲配制成1mol/LNaOH溶液,应取原溶液与蒸馏水的体积比约( )
| A、1:2 | B、1:3 |
| C、2:1 | D、2:3 |
下列元素均位于第ⅦA族,其中非金属性最弱的元素是( )
| A、F | B、Cl | C、Br | D、I |
下列离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、澄清石灰水跟稀硝酸反应:Ca(OH)2+2H+═Ca2++2H2O |
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| D、铁粉投入到硫酸铜溶液中:Fe+Cu2+═Fe2++Cu |
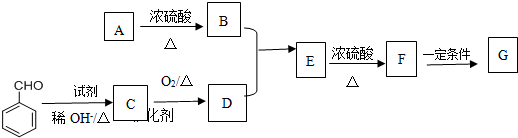
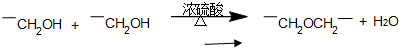
 符合如图所示关系的D有几种( )
符合如图所示关系的D有几种( )| A、1 | B、2 | C、3 | D、4 |