题目内容
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)?xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 .
(2)x= ;平衡常数K= .
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
(1)从反应开始至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)=
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为
考点:化学平衡的计算,反应速率的定量表示方法,等效平衡
专题:化学平衡专题
分析:(1)依据化学反应速率的概念分析计算;
(2)依据平衡三段式列式计算,平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变;
(4)反应前后气体体积不变,加入C增大压强,平衡不动;反应物的转化率不变,依据(2)计算得到;
(5)依据化学反应达到平衡时“等量等效”的方法分析计算满足的关系.
(2)依据平衡三段式列式计算,平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变;
(4)反应前后气体体积不变,加入C增大压强,平衡不动;反应物的转化率不变,依据(2)计算得到;
(5)依据化学反应达到平衡时“等量等效”的方法分析计算满足的关系.
解答:
解:(1)平衡时C的浓度为0.4mol/L,依据化学反应速率概念计算得到:C的反应速率=
=0.2mol/L?min,故答案为:0.2mol/L?min;
(2)t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)?xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8mol B,并测得C的浓度为0.4mol/L物质的量为0.8mol,
3A(g)+B(g)?xC(g),
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.8
平衡量(mol) 2.4 0.8 0.8
1:x=0.2:0.8=1:4,x=4
平衡浓度c(A)=
=1.2mol/L,c(B)=0.4mol/L,c(C)=0.4mol/L
平衡常数K=
=
;
故答案为:4;
;
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变,故答案为:C;
(4)若向原平衡混合物的容器中再充入a mol C,在t℃时达到新的平衡,反应前后气体体积不变,加入C增大压强,平衡不动;反应物的转化率不变,加入amolC,相当于AB的起始量为
amol,
amol,依据(2)可知AB的转化率为20%,B反应物质的量
a×20%=0.05amol,生成C0.2amol,则此时B的物质的量为n(B)=0.8+0.2a;
故答案为:0.8+0.2a;
(5)在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C),转化为起始量和原平衡相同;
3A(g)+B(g)?4C(g)
3 1 0
n(A) n(B) n(C)
n(A)+
n(C) n(B)+
n(C) 0
n(A)+
n(C)=3
n(B)+
n(C)=1
n(A)=3n(B),n(C)>0或n(A)+
n(C)=3[n(B)+
n(C)]
故答案为:n(A)=3n(B),n(C)>0或n(A)+
n(C)=3[n(B)+
n(C)].
| 0.4mol/L |
| 2min |
(2)t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)?xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8mol B,并测得C的浓度为0.4mol/L物质的量为0.8mol,
3A(g)+B(g)?xC(g),
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.8
平衡量(mol) 2.4 0.8 0.8
1:x=0.2:0.8=1:4,x=4
平衡浓度c(A)=
| 2.4mol |
| 2L |
平衡常数K=
| 0.44 |
| 1.23×0.4 |
| 1 |
| 27 |
故答案为:4;
| 1 |
| 27 |
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变,故答案为:C;
(4)若向原平衡混合物的容器中再充入a mol C,在t℃时达到新的平衡,反应前后气体体积不变,加入C增大压强,平衡不动;反应物的转化率不变,加入amolC,相当于AB的起始量为
| 3 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
故答案为:0.8+0.2a;
(5)在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C),转化为起始量和原平衡相同;
3A(g)+B(g)?4C(g)
3 1 0
n(A) n(B) n(C)
n(A)+
| 3 |
| 4 |
| 1 |
| 4 |
n(A)+
| 3 |
| 4 |
n(B)+
| 1 |
| 4 |
n(A)=3n(B),n(C)>0或n(A)+
| 3 |
| 4 |
| 1 |
| 4 |
故答案为:n(A)=3n(B),n(C)>0或n(A)+
| 3 |
| 4 |
| 1 |
| 4 |
点评:本题考查了化学平衡的计算应用,影响平衡因素的理解应用,等效平衡的计算判断,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
A、按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 |
| B、乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
| C、乙醛的官能团为:-COH |
| D、常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 |
下列有关硅及其化合物的叙述中,错误的是( )
| A、单质硅是良好的半导体材料 |
| B、硅和碳是都是第ⅣA族的元素 |
| C、二氧化硅用来制造通讯材料(光导纤维) |
| D、二氧化硅溶于水生成硅酸,它是挥发性酸 |
胶体最本质的特征是( )
| A、有丁达尔效应 |
| B、可以通过滤纸 |
| C、分散质是水 |
| D、分散质粒子的直径在1~100 nm之间 |
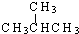 和
和 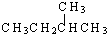 ②
②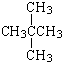 和
和