题目内容
【题目】电解原理在工业中有广泛应用。如图是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
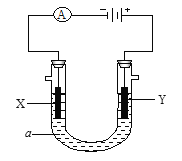
请回答以下问题:
(1) 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是: 。
在X极附近观察到的现象是: 。
②Y电极上的电极反应式是: ,
检验该电极反应产物的方法是: 。
(2) 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是: ,电极反应式是: 。
②Y电极的材料是: ,电极反应式是: 。
(说明:杂质发生的电极反应不必写出)
【答案】(1)①2H++2e-=H2↑(2分)放出气体,溶液变红。(2分)
②2Cl--2e-=Cl2↑(2分)把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。(2分)
(2)①纯铜(1分)Cu2++2e-=Cu(1分)
②粗铜(1分)Cu-2e-=Cu2+(1分)
【解析】
试题解析:(1) X极为电解池的阴极,发生还原反应,溶液中的氢离子得电子变氢气;2H+ + 2e- = H2↑;在阴极附近有气泡产生,溶液中氢离子浓度减小,氢氧根离子浓度增大,酚酞遇碱变红;Y电极为电解池的阳极,氯离子失电子变为氯气;2Cl- - 2e- = Cl2 ↑;氯气有氧化性,能够把碘离子氧化为碘单质,遇淀粉变蓝;(2) 电解精炼粗铜,粗铜做阳极,纯铜作阴极,含有铜离子的溶液做电解液,所以:X电极的材料纯铜;溶液中的铜离子发生还原反应: Cu2+ + 2e - = Cu;Y电极的材料是粗铜,金属铜失电子,发生氧化反应;Cu - 2e - = Cu2+;

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D